
【题目】药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:

下列有关叙述正确的是( )
A. 贝诺酯分子中有三种含氧官能团
B. 可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C. 乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D. 贝诺酯与足量NaOH 溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠
科目:高中化学 来源: 题型:
【题目】钴的合金及其配合物用途非常广泛。已知Co3+比Fe3+的氧化性更强,在水溶液中不能大量存在。
(1)Co3+的核外电子排布式为__________________________。
(2)无水CoCl2的熔点为735℃、沸点为1049℃,FeCl3熔点为306℃、沸点为315℃。CoCl2属于_________晶体,FeCl3属于__________晶体。
(3)BNCP可用于激光起爆器等,可由HClO4、CTCN、NaNT共反应制备。
①![]() 的空间构型为______________。
的空间构型为______________。
②CTCN的化学式为[Co(NH3)4CO3]NO3,与Co(Ⅲ)形成配位键的原子是_______{已知 ![]() 的结构式为
的结构式为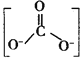 }。
}。
③NaNT可以![]() (双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(双聚氰胺)为原料制备。1 mol双聚氰胺分子中含σ键的数目为____________。
(4)Co与CO作用可生成Co2(CO)8,其结构如图所示。该分子中C原子的杂化方式为_________________。
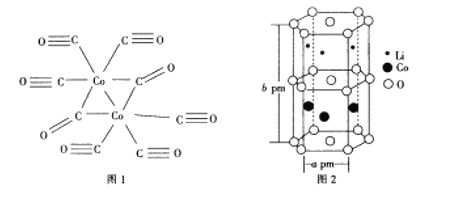
(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为___________。已知NA为阿伏加德罗常数的数值,则该晶胞的密度为__________(用含a、b、NA的代数式表示)g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氮和氮的化合物在国防建设、工农业生产和生活中都有极其广泛的用途。请回答下列与氮元素有关的问题:
(1)亚硝酸氯(结构式为Cl-N=O)是有机合成中的重要试剂。它可由Cl2和NO在通常条件下反应制得,反应方程式为2NO(g)+Cl2(g)![]() 2ClNO(g)。已知几种化学的键能数据如下表所示:
2ClNO(g)。已知几种化学的键能数据如下表所示:

当Cl2与NO反应生成ClNO的过程中转移了5mol电子,理论上放出的热量为____kJ.
(2)在一个恒容密闭容器中究入2molNO(g)和1 mol Cl2(g)发生(1)中反应,在温度分别为T1、T2时测得NO的物质的量(单位:mol)与时间的关系如下表所示
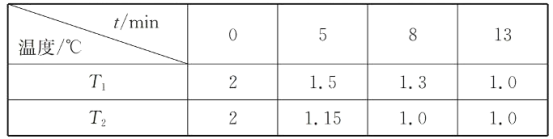
①T1________T2(填“>“”<”或”=”)。
②温度为T2℃时,起始时容器内的强为p0,则该反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)近年来,地下水中的氮污染已成为一个世界性的环境问题。在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3-),其工作原理如图所示
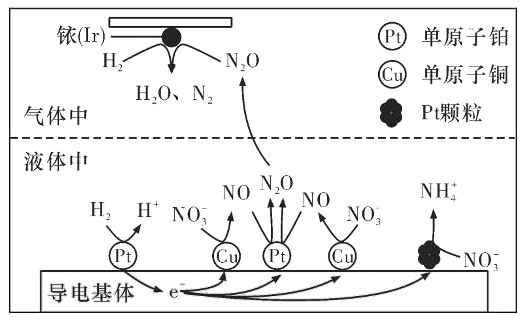
①Ir表面发生反应的方程式为_____________。
②若导电基体上的Pt颗粒增多,造成的后果是______________。
II:利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来精炼银,装置如图所示
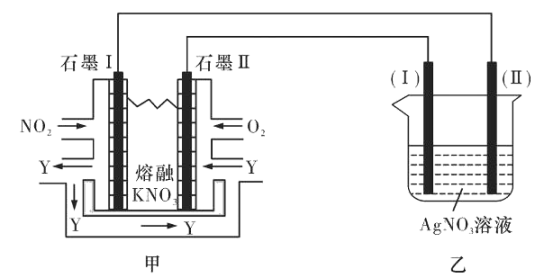 请回答下列问题:
请回答下列问题:
(4)①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5,可循环使用,则石墨Ⅱ附近发生的电极反应式为________。
②若用10A的电流电解60min后,乙中阴极得到32.4gAg,则该电解池的电解效率为____%。(保留小数点后一位。通过一定电量时阴极上实际沉积的金属质量与通过相同电量时理论上应沉积的金属质量之比叫电解效率。法拉第常数为96500C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照给定元素的位置,回答下列问题:
周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)元素④、⑤、⑥的原子半径由大到小的顺序为___(用元素符号表示)。
(2)元素③、⑦的最高价含氧酸的酸性由强到弱的顺序为__。(用化学式表示)
(3)碱性强弱比较:元素⑤的氢氧化物__⑥的氢氧化物(用<、=、>填空);两者相互反应的离子方程式为__。
(4)由元素⑤和⑧共同组成的化合物的电子式为__、它属于__化合物。(填“共价”或“离子”)
(5)由元素①⑧形成的化合物A和由元素④⑤⑧的化合物B,可相互反应产生黄绿色气体单质,该反应的离子方程式为__;该黄绿色气体单质会使得湿润淀粉碘化钾试纸变蓝色,表明生成了碘单质(I2),由此推测这两种元的气态氢化物的稳定性强弱顺序为:__。(用化学式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等浓度的下列溶液:①醋酸,②苯酚,③苯酚钠,④碳酸,⑤碳酸钠,⑥碳酸氢钠。按溶液pH由小到大排列正确的是
![]()
![]() A. ④①②⑤⑥③ B. ④①②⑥⑤③
A. ④①②⑤⑥③ B. ④①②⑥⑤③
![]()
![]() C. ①④②⑥③⑤ D. ①④②③⑥⑤
C. ①④②⑥③⑤ D. ①④②③⑥⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂存在下可发生偶联反应,称为Glaser反应。2R-C≡C-H![]() R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:
R-C≡C-C≡C-R+H2, 该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应制备化合物E的一种合成路线:

回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为______。用1 mol E合成1,4二苯基丁烷,理论上需要消耗氢气__ mol。
(4)化合物(![]() )也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
)也可发生Glaser偶联反应生成聚合物,该聚合反应的化学方程式为__________。
(5)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,写出其中3种的结构简式_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A,B,C,D,E、F六种元素的原子序数依次增大,其中A元素的原子半径在短周期元素中最小;B原子核外电子有6种不同的运动状态;D原子L层上有2对成对电子。E元素在地壳中含量居第二位,F 与E位于同一周期,且是该周期元素中电负性最大的元素。
根据以上信息回答下列问题:
(1)E元素可分别与D元素、F元素形成两种常见化合物,这两种化合物的熔沸点高低顺序为____________(用化学式表示),原因是_____________________。
(2)C的氢化物比下周期同族元素的氢化物沸点还要高,其原因是____________。
(3)1 mol B2A2分子中含σ键的数目是____________。
(4)图(Ⅰ)是B元素的单质晶体的一个晶胞,该晶胞中含有_____个原子,该晶体类型为________。
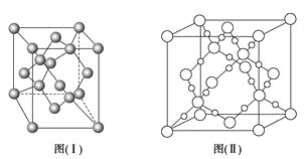
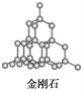
(5)E单质存在与金刚石结构类似的晶体,晶体中原子之间以_________相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
(6)BD2在高温高压下所形成的晶体其晶胞如图(Ⅱ)所示。该晶体的类型属于_______(填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子轨道的杂化类型为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
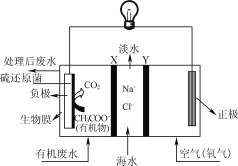
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,有两种溶液:①0.01 mol·L-1 NH3·H2O溶液、②0.01 mol·L-1 NH4Cl溶液,下列操作可以使两种溶液中c(NH4+)都增大的是
A.通入少量HCl气体 B.加入少量NaOH固体
C.加入少量H2O D.适当升高温度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com