
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g/cm3,溶质的质量分数为w,溶质的物质的量浓度为c mol/L.下列叙述中正确的是()
①w=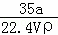 ×100%
×100%
②c=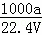
③向上述溶液中再加入V mL水后,所得溶液的质量分数大于0.5w.
A. ①③ B. ②③ C. ①② D. 只有②
考点: 物质的量浓度的相关计算.
专题: 物质的量浓度和溶解度专题.
分析: ①根据ω= ×100%计算氨水中溶质的质量分数;
×100%计算氨水中溶质的质量分数;
②根据c=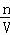 计算所得氨水的物质的量浓度;
计算所得氨水的物质的量浓度;
③水的密度大于氨水的密度,所以等体积时,水的质量大于氨水的质量,这样混合后,所得溶液浓度小于0.5ω,根据公式溶质质量分数= ×100%计算.
×100%计算.
解答: 解:①氨气溶于水,主要以NH3•H2O存在,但仍然以NH3作为溶质,ω= ×100%=
×100%=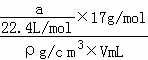 ×100%=
×100%=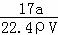 ×100%,故①错误;
×100%,故①错误;
②所得氨水中溶液的物质的量浓度为:c=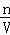 =
=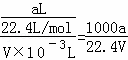 mol/L,故②正确;
mol/L,故②正确;
③溶质质量分数= ×100%=
×100%= =
= ×w,由于氨水的密度小于水,则ρ
×w,由于氨水的密度小于水,则ρ <0.5,
<0.5,
所得氨水的质量分数<0.5w,故③错误;
故选D.
点评: 本题考查了物质的量浓度的有关计算,题目难度中等,明确密度比水小的两种不同浓度溶液混合,等体积混合后所得溶液中溶质的质量分数小于等质量混合后所得溶液中溶质的质量分数(即两种溶液中溶质的质量分数之和的一半),如氨水、酒精溶液.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
只用一种试剂就能把Na2SO4、NaCl、(NH4)2SO4、NH4Cl四种溶液区分开来,这种试剂是()
A. AgNO3 B. NaOH C. BaCl2 D. Ba(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
|
| A. | X与Y形成化合物是,X显负价,Y显正价 |
|
| B. | 第一电离能可能Y大于X |
|
| C. | 当它们均为非金属时,气态氢化物的稳定性:X大于Y |
|
| D. | 当它们均为非金属时,最高价含氧酸的酸性:X小于Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高.
(1)基态钛原子的核外电子排布式为 .
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于 晶体.
(3)SO42﹣和 S2O82﹣(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.下列说法正确的是 .
A.SO42﹣中存在σ键和π键且与PO43﹣离子互为等电子体
B.S2O82﹣中存在非极性键且有强氧化性
C.S2O82﹣比SO42﹣稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ,原因是 .
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ,分子的空间构型为 .
(6)在一定条件下铁形成的晶体的基本结构单元如图1和图2所示,则图1和图2的结构中铁原子的配位数之比 .
查看答案和解析>>
科目:高中化学 来源: 题型:
除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法均正确的一组是()
选项 待提纯的物质 选用的试剂 操作的方法
A CaO(CaCO3) 水 溶解、过滤、结晶
B Cu(CuO) 稀盐酸 溶解、过滤、洗涤、干燥
C CuSO4(H2SO4) 氢氧化钠溶液 过滤
D CO(H2) 氧气 点燃
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
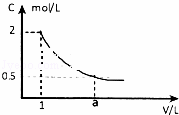
(1)如图是某溶液稀释过程中,溶液的物质的量浓度随溶液体积的变化曲线图,根据图中数据分析得出a 值等于4.
(2)在金属活动性顺序里,位于氢后面的金属Cu,在常温下虽然不能与稀盐酸、稀硫酸反应,但可以与稀硝酸反应,其化学方程式为:3Cu+8HN03(稀)═3Cu(NO3)2+2NO↑+4H2O在1.92g Cu中加入100mL稀HNO3溶液,如恰好完全反应,计算生成NO在标准状况下的体积和反应前稀HNO3溶液中溶质的物质的量浓度?(请写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
由铜片、锌片和200mL稀H2SO4组成的原电池中,若锌片发生电化学腐蚀,则当铜片上放出3.36L(标态)气体时,硫酸恰好全部作用完.试计算:
(1)产生这些气体消耗了多少克锌
(2)有多少个电子通过了导线
(3)200mL稀H2SO4的物质的量浓度是多少.
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: ,下列说法不正确的是()
,下列说法不正确的是()
A. ①和②变化过程中都会放出热量
B. 氯原子吸引电子的能力强于钠原子和氢原子
C. ①和②中的氯原子均得到1个电子达到8电子稳定结构
D. NaCl中含有离子键,HCl中含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com