
【题目】工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图所示装置。

实验原理:Cu2S+O2![]() SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
SO2 +2Cu,通过测定SO2的量来确定Cu2S的质量分数。实验时按如下步骤操作:
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000 g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1 L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为Cu2S+O2![]() SO2+2Cu。
SO2+2Cu。
F.移取25.00 mL含SO2的水溶液于250 mL锥形瓶中,用0.010 0 mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2~3次。
试回答下列问题:
(1)装置①的作用是______________;装置②的作用是____________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的离子方程式为___。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.04 | 21.03 |
2 | 25.00 | 1.98 | 21.99 |
3 | 25.00 | 3.20 | 21.24 |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是____________(写一种即可)。
【答案】除去空气中可能含有的还原性气体与酸性气体 干燥空气 2MnO4—+5H2SO3===2Mn2++5SO42—+4H++3H2O (或2MnO4—+5SO2 +2H2O===2Mn2++5SO42—+4H+ ) )80% 在用KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低(答案合理即可)
【解析】
(1)装置①中的溶液是高锰酸钾溶液与氢氧化钾溶液的混合溶液,目的是为了吸收空气中可能含有的还原性气体与酸性气体,避免对测定结果产生误差,装置②干燥管中的碱石灰可除去空气中混有的水蒸气。
所以本题答案:除去空气中可能含有的还原性气体与酸性气体 ;干燥空气;
(2) SO2溶于水中生成亚硫酸,形成亚硫酸溶液,高锰酸钾具有强氧化性,可以将亚硫酸根离子氧化为硫酸根离子,高锰酸钾被还原为硫酸锰,其反应的离子方程式为2MnO4-+5H2SO3===2Mn2++5SO42-+4H++3H2O或2MnO4-+5SO2+2H2O===2Mn2++5SO42-+4H+。所以本题答案:2MnO4—+5H2SO3===2Mn2++5SO42—+4H++3H2O (或2MnO4—+5SO2 +2H2O===2Mn2++5SO42—+4H+ )
(3)第3组数据误差太大,舍去,前两组消耗高锰酸钾溶液平均体积为[(21.03-1.04)+(21.99-1.98)]÷2=20.00mL,浓度为0.010 0 mol/L,高锰酸钾的物质的量为0.010 0 mol/L×0.02 L=0.000 2 mol,根据反应分析,得:
5Cu2S~5SO2~5H2SO3~2KMnO4
5 2
n 0.000 2 mol
则n=0.000 5 mol。辉铜矿样品中硫化亚铜的质量分数=(0.000 5 mol×160g/mol×250/25)/1.00g×100%=80%。
所以本题答案:80%。
(4)H2SO3具有还原性,未反应完的O2与空气中的氧气会把H2SO3部分氧化,则滴定时与高锰酸钾反应的H2SO3减少,造成测定结果偏低。
所以本题答案:在用KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低。


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
【题目】燃煤的烟气中含有 SO2,为了治理雾霾天气,工厂采用多种方法实现烟气脱硫。
Ⅰ.(1)“湿式吸收法”利用吸收剂与 SO2 发生反应从而脱硫。下列试剂中适合用作该法吸收剂的是_____(填字母序号)。
a. 石灰乳 b.CaCl2溶液
(2)某工厂利用含 SO2 的烟气处理含Cr2O72-的酸性废水,吸收塔中反应后的铬元素以Cr3+形式存在,具体流程如下:
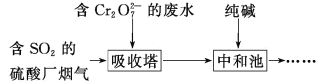
①用 SO2 处理含铬废水时,利用了 SO2 的_____性。
②吸收塔中发生反应的离子方程式为_____。
Ⅱ.石灰-石膏法和烧碱法是常用的烟气脱硫法。石灰-石膏法的吸收反应为Ca(OH)2+SO2= CaSO3↓+H2O。吸收产物亚硫酸钙由管道输送至氧化塔氧化,反应为2CaSO3+O2+4H2O =2CaSO4·2H2O。其流程如图:
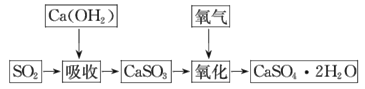
烧碱法的吸收反应为2NaOH+SO2=Na2SO3+H2O。该法的特点是氢氧化钠碱性强、吸收快、效率高。其流程如图:

已知:
试剂 | Ca(OH)2 | NaOH |
价格(元/kg) | 0.36 | 2.9 |
吸收 SO2 的成本(元/mol) | 0.027 | 0.232 |
(3)石灰-石膏法和烧碱法相比,石灰-石膏法的优点是_______,缺点是_______。
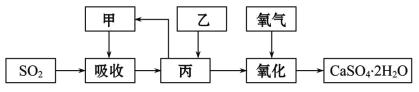
(4)某学习小组在石灰-石膏法和烧碱法的基础上,设计一个改进的、能实现物料循环的烟气脱硫方案,流程图中的甲、乙、丙各是_____、_____、_____(填化学式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质转化关系的说法中不正确的是( )

A. 图1中甲可能是Cl2,X可能是Fe
B. 图2中反应一定是置换反应或复分解反应
C. 图3中是向某溶液中滴加NaOH溶液的变化图像,原溶质可能是Al2(SO4)3
D. 图4中a可能为NaOH,b可能为Na2CO3,c可能为NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述正确的是( )
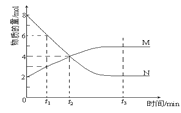
A.反应的化学方程式:2M![]() N
N
B.t2时,正、逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的L层电子数是K层电子数的两倍,C在空气中燃烧时呈现黄色火焰,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物,试根据以上叙述回答:
(1)元素名称:A______B______C______D______
(2)D元素位于周期表中第______周期第______族.C2B2的电子式:_________,所含化学键类型______________。
(3)AB2的电子式:___________写出AB2与C2B2反应的化学方程式____________________。
(4)画出B的原子结构示意图_____________。
(5)用电子式表示化合物C2D的形成过程:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中, M棒变细,N棒变粗.由此判断下表中所列M、N、R物质,其中合理的是( )

M | N | R | |
A | 锌 | 铜 | 稀硫酸 |
B | 铜 | 铁 | 稀盐酸 |
C | 铁 | 铜 | 硝酸银 |
D | 铜 | 铁 | 氯化铁 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5mL稀盐酸。
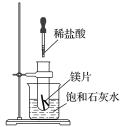
回答下列问题:
(1)实验中观察到的现象是________________。
(2)产生上述现象的原因是________________。
(3)写出有关反应的离子方程式____________。
(4)由实验推知,MgCl2溶液和H2的总能量________(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
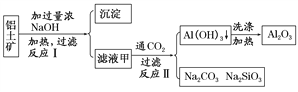
(1)滤液甲的主要成分是(写化学式___________________________________________。
(2)写出反应Ⅱ的离子方程式:______________________________________________。
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是__________(填字母)。
A.AlO![]() B.OH- C.SiO
B.OH- C.SiO![]()
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为________________________________________________________________________。
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解。
加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Li和石墨的复合材料以及纳米Fe2O3材料作电极的锂离子电池,在循环充放电过程中可实现对磁性的可逆调控(如图)。下列有关说法一定错误的是
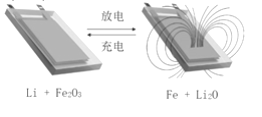
A. 该电池的电解质溶液可以是硫酸溶液
B. 放电时,总反应式是6Li+Fe2O3=3Li2O+2Fe
C. 充电时,阳极的电极反应是2Fe+3Li2O-6e-= Fe2O3+6Li+
D. 充放电过程中,电池可在被磁铁不吸引和吸引之间循环调控
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com