
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4 溶液显酸性,关于 NaHC2O4 溶液中离子浓度关系的叙述不正确的是
A.c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4)
)>c(H2C2O4)
B.c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2C2O4)
)+c(H2C2O4)
C.c(Na+)+c(H+)=c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
D.c(H+)+c(H2C2O4)=c(![]() )+c(OH-)
)+c(OH-)
【答案】C
【解析】
A.草酸是二元弱酸,0.2 mol·L-1NaHC2O4 溶液显酸性,说明H2C2O4电离程度大于水解程度,但是其电离和水解程度都较小,钠离子不水解,则溶液中离子浓度大小顺序为c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2C2O4),故A正确;
)>c(H2C2O4),故A正确;
B.溶液中存在物料守恒;c(Na+)=c(HC2O-)+c(C2O2-)+c(H2C2O4),故B正确;
C.溶液中存在电荷守恒:c(Na+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),故C错误;
)+c(OH-),故C错误;
D.溶液中存在物料守恒c(Na+)=c(HC2O-)+c(C2O2-)+c(H2C2O4),液中存在电荷守恒c(Na+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),溶液中电荷守恒减物料守恒得c(H+)+c(H2C2O4)=c(
)+c(OH-),溶液中电荷守恒减物料守恒得c(H+)+c(H2C2O4)=c(![]() )+c(OH-),故D正确;
)+c(OH-),故D正确;
故答案:C。


科目:高中化学 来源: 题型:
【题目】将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g)![]() 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与社会生活密切相关,下列说法正确的是( )
A.军舰船底镶嵌锌块作正极,以防船体被腐蚀
B.汽车尾气中NO和CO可以缓慢反应生成N2和CO2,减小压强,反应速率减慢
C.金属冶炼过程是金属离子得电子变成金属单质的氧化过程
D.PM2.5颗粒![]() 微粒直径约为2.5×106m)分散在空气中形成气溶胶
微粒直径约为2.5×106m)分散在空气中形成气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某烷烃![]() 与烯烃
与烯烃![]() 的混合气体
的混合气体![]() ,其密度为同状况下
,其密度为同状况下![]() 密度的11.2倍,将混合气体通过足量的溴水,溴水增重
密度的11.2倍,将混合气体通过足量的溴水,溴水增重![]() ,回答下列问题:
,回答下列问题:
(1)写出结构简式:![]() ________,
________,![]() ________。
________。
(2)![]() 与丁烯互为________(填“同分异构体”或“同系物”)。
与丁烯互为________(填“同分异构体”或“同系物”)。
(3)写出![]() 与溴水反应的化学方程式:________________。
与溴水反应的化学方程式:________________。
(4)下列有关![]() 的结构或性质的说法正确的是________(填序号)。
的结构或性质的说法正确的是________(填序号)。
A 不能使酸性高锰酸钾溶液褪色,但能使溴的四氯化碳溶液褪色
B 分子中所有原子都在同一平面上
C 分子中有7个单键
D 与![]() 在一定条件下能加成并只得到一种产物
在一定条件下能加成并只得到一种产物
Ⅱ.(5)已知甲苯(![]() )能使酸性
)能使酸性![]() 溶液褪色。某有机物的结构简式为
溶液褪色。某有机物的结构简式为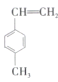 ,下列说法正确的是________(填序号)。
,下列说法正确的是________(填序号)。
A 该有机物使溴水褪色和在催化剂作用下与液溴反应原理一样
B 能用酸性![]() 溶液判断分子中存在碳碳双键
溶液判断分子中存在碳碳双键
C 该有机物在一定条件下与浓硝酸发生反应生成的苯环上的一硝基取代物可能有3种
D ![]() 该有机物在一定条件下最多与
该有机物在一定条件下最多与![]() 发生加成反应
发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在某一化学反应中,反应物B的浓度在5s内从2.0mol/L变成0.5mol/L,在这5s 内B的化学反应速率为多少______?
(2)一个5L的容器中,盛入8.0mol某气体反应物,5min后,测得这种气体反应物还剩余 6.8mol,这种反应物的化学反应速率为多少_________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有室温下四种溶液,有关叙述不正确的是
编号 | ① | ② | ③ | ④ |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A.相同体积③、④溶液分别与 NaOH 完全反应,消耗 NaOH 物质的量:③>④
B.分别加水稀释 10 倍,四种溶液的 pH:①>②>④>③
C.①、④两溶液等体积混合,所得溶液中 c(![]() )>c(Cl-)>c(OH-)>c(H+)
)>c(Cl-)>c(OH-)>c(H+)
D.在③溶液中:c(H+)=c(CH3COO-)+c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期元素性质的递变规律,设计了如下实验。
(1)将等质量的钠、镁、铝分别投入到足量的相同浓度的盐酸中,试预测实验结果:上述金属中___(填化学式,下同)与盐酸反应最剧烈,___与盐酸反应生成的气体最多。
(2)向Na2S溶液中通入氯气出现淡黄色浑浊现象,可证明S、Cl元素非金属性强弱顺序为___,反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理被广泛地应用于生产、生活的许多方面。
I.制备氯气
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。

(1)此过程中能量转化形式为_____转化为_____(填“化学能”或“电能”)
(2)电极乙为_____(填“阴极”或“阳极”),A 口生成的气体是_____
(3)电解饱和食盐水的离子方程式是 _____
(4)下列有关氯气的说法中正确的是_____
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
II.金属防护
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。

(5)被腐蚀的是包裹_____的铁钉(填“锌片”或“铜片”)
(6)结合电极反应式解释 i 中现象产生的原因_____
(7)结合以上实验,请对铁制零件的使用提出建议_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com