
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | ||||
| CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||||
| 1 | 500 | 2 | 4 | 0 | 1 | ||
| 2 | 500 | 1.4 | 2.8 | 0.6 | a | ||
| 3 | 750 | 0 | 0 | 2 | 0.8 | ||
| 4 | 750 | 0.8 | 1.6 | 1.2 | b | ||
分析 (1)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根据盖斯定律知,①+②×,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l);
(2)①利用三段式求得500℃时的平衡常数K,根据题中数据求得Qc的值,根据K与Qc判断反应方向,根据转化率=$\frac{已转化的量}{起始量}$×100%计算;
②根据K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}(H{\;}_{2})}$计算;
③750℃恒压条件十,达到平衡时CO的体积分数为W%,即与原平衡为成比例的等效平衡,将生成物折算成反应后,各反应物的物质的量之比相等可;
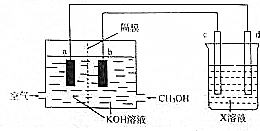
(3)在甲醇燃料电池中,甲醇是还原剂,在电池的负极反应,生成碳酸根离子,氧气是氧化剂,在正极发生还原反应,生成氢氧根离子,根据装置图可知,b极为负极,a为正极,所以d为阳极,c为阴极,电解精炼铜时用粗铜作阳极,用硫酸铜溶液作电解质溶液,据此答题;
解答 解:(1)①2H2(g)+O2(g)=2H2O(l)△H1=-571.6kJ•mol-1
②2CO(g)+O2(g)=2CO2(g)△H2=-566.0kJ•mol-1
③CO(g)+2H2(g)═CH3OH(g)△H3=-90.8kJ•mol-1
根据盖斯定律知,①+②×$\frac{1}{2}$-③得:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-571.6kJ•mol-1-566.0kJ•mol-1×$\frac{1}{2}$+90.8kJ•mol-1=-763.8kJ•mol-1,所以甲醇蒸汽燃烧热的热化学方程式为CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1 ,
故答案为:CH3OH(g)+$\frac{3}{2}$O2(g)=CO2(g)+2H2O(l),△H=-763.8kJ•mol-1 ;
(2)①利用三段式,根据题中数据有,
CO(g)+2H2(g)=CH3OH(g)
起始(mol/L) 1 2 0
转化(mol/L) 0.5 1 0.5
平衡(mol/L) 0.5 1 0.5
所以平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}(H{\;}_{2})}$=$\frac{0.5}{0.5×{1}^{2}}$=1,根据题中数据实验2中,Qc=$\frac{0.3}{1.{4}^{2}×0.7}$=0.22<1,所以反应向正反应方向进行,CO的转化率为=$\frac{0.5}{1}$×100%=50%,
故答案为:正;50%;
②利用三段式,根据题中数据有750℃时,
CO(g)+2H2(g)=CH3OH(g)
起始(mol/L) 0 0 1
转化(mol/L) 0.4 0.8 0.4
平衡(mol/L) 0.4 0.8 0.4
所以平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}(H{\;}_{2})}$=$\frac{0.4}{0.{8}^{2}×0.4}$=1.56,
故答案为:1.56;
③利用三段式,根据题中数据有750℃时,
CO(g)+2H2(g)=CH3OH(g)
起始1(mol/L) 0.4 0.8 0.6
折算后(mol/L) 1 2 0
起始2(mol/L) x y 0
所以有x:y=1:2,
故答案为:x:y=1:2;
(3)在甲醇燃料电池中,甲醇是还原剂,在电池的负极反应,生成碳酸根离子,氧气是氧化剂,在正极发生还原反应,生成氢氧根离子,根据装置图可知,b极为负极,a为正极,所以d为阳极,c为阴极,电解精炼铜时用粗铜作阳极,用硫酸铜溶液作电解质溶液,
①根据上面的分析可知,应选粗铜作d电极的电极材料,C电极的名称为阴极,X溶液为 硫酸铜溶液,
故答案为:粗铜;阴;硫酸铜;
②b电极为甲醇发生氧化反应,生成碳酸根离子,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,
故答案为:CH3OH-6e-+8OH-=CO32-+6H2O;
③电解精炼过程中a电极上氧气是氧化剂,在正极发生还原反应,生成氢氧根离子,所以溶液的溶液的pH会增大,
故答案为:增大.
点评 本题考查化学平衡的标志、平衡常数的计算及化学平衡移动原理、盖斯定律的计算应用等,知识点较多,综合性很强,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 0.1 mol•L-1的CuCl2溶液中含Cu2+为0.1NA | |
| B. | 标准状况下,22.4 L CCl4含CCl4分子为NA | |
| C. | 1mol H3O+含质子数为10 NA | |
| D. | 1mol Na2O2混合物中含阴离子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
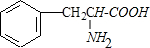 .
.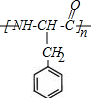 .
.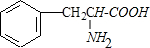 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$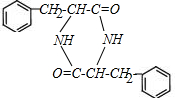 +2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).
+2H2O;M与乙醇在浓硫酸、加热条件下发生反应的类型为酯化反应(取代反应).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2++2OH-═Cu(OH)2↓ CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | CO32-+2H+═CO2↑+H2O BaCO3+2HCl═BaCl2+CO2↑+H2O | |
| C. | Ca2++CO32-═CaCO3↓ Ca(NO3)2+NaCO3═CaCO3↓+NaNO3 | |
| D. | H++OH-═H2O 2KOH+H2SO4═K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯(甲苯):加酸性高锰酸钾溶液、再加NaOH溶液,分液 | |
| B. | 乙烷(乙烯),催化条件下通入H2 | |
| C. | 乙酸(乙醛),加入新制氢氧化铜,蒸馏 | |
| D. | 乙醛(乙酸),加入氢氧化钠溶液洗涤,蒸馏 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com