
| A. | Fe2O3 | B. | Fe(OH)3 | C. | FeO | D. | Fe3O4 |
科目:高中化学 来源: 题型:填空题
 新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示.回答下列问题:
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2,电解质为KOH溶液.某研究小组将甲烷燃料电池作为电源,进行饱和氯化钠溶液电解实验,如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 v(C)正=3v(D)逆 | |
| B. | 若升高温度最终能生成更多的C和D | |
| C. | 单位时间里有4n mol A消耗,同时有5n mol B生成 | |
| D. | 容器里A、B、C、D的浓度比一定是4:5:4:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F2、Cl2、Br2、I2的熔点、沸点逐渐升高 | |
| B. | Li、Na、K、Rb熔沸点依次减弱 | |
| C. | 金刚石的硬度、熔点、沸点都高于晶体硅 | |
| D. | NaF、NaCl、NaBr、NaI的熔点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个制取氯气并进行某些反应的装置.(夹持和加热装置省略)
如图是一个制取氯气并进行某些反应的装置.(夹持和加热装置省略)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向浓度为0.1 mol/L 的FeI2溶液中通入Cl2,Fe2+先反应 | |
| B. | 向NH4Al(SO4)2溶液中滴加少量的NaOH溶液,NH4+先反应 | |
| C. | 向浓度均为0.1 mol/L的Na2CO3和NaOH混合溶液通入CO2气体,NaOH先反应 | |
| D. | 向等浓度的FeCl3溶液加入质量相等且颗粒大小相同的铁和铜,铜先反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
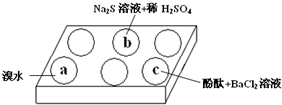 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:| n(SO3 2-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol铁在氯气中完全反应失去的电子数为0.2NA | |
| B. | 常温常压下,1L 0.1mol•L-1氯化铝溶液中含有0.3 NA个Cl- | |
| C. | 标准状况下,22.4L氨水中含有NA个NH3分子 | |
| D. | 常温常压下,24g镁条投入足量稀硫酸中生成22.4L H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com