
【题目】用均滴有酚酞试液和氯化钠溶液的滤纸分别制作甲、乙两个装置。下列描述正确的是( )
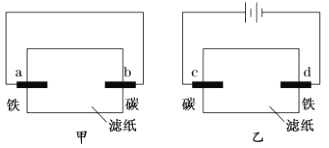
A.滤纸上的阴离子都向碳棒迁移
B.a、d两极的电极反应式相同
C.b、d两极附近的溶液都变红
D.c、d两极均有少量气体产生
【答案】CD
【解析】
试题分析:甲构成原电池,乙为电解池,甲中铁易失电子作负极、碳作正极,负极上Fe-2e-=Fe2+,正极上电极反应式为2H2O+O2+4e-=4OH-,导致b电极附近溶液碱性增强;乙中阴极上电极反应式为:2H++2e-=H2↑,水电离出的氢离子放电,导致阴极d附近有大量OH-,溶液碱性增强,无色酚酞试液遇碱变红色;
A.甲中阴离子向负极铁棒迁移,乙中滤纸上的阴离子向阳极碳棒迁移,故A错误;B.a电极Fe失电子氧化,d电极表明H+失电子衩被氧化为H2,故B错误;C.结合分析,b、d两极附近的溶液都变红,故C正确;D.乙为电解池,c上有氯气、d电极有氢气生成,故D正确,答案为CD。


科目:高中化学 来源: 题型:
【题目】下图表示氮及其化合物在一定条件下的转化关系:
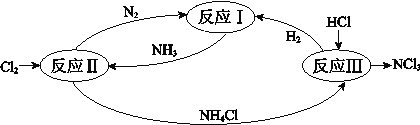
(1)① 反应II的化学方程式是______。
② 反应II其中一步反应为2NH3 (g)+3Cl2(g) =N2 (g) +6HCl(g) ΔH=–462 kJmol-1
已知:![]()
![]()
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为_______ kJ。
(2)反应III是利用右图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3 +3H2↑。
NCl3 +3H2↑。
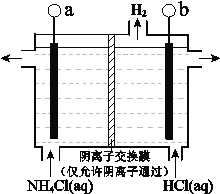
① b接电源的_______极(填“正”或“负”)。
② 阳极反应式是_______。
(3)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种将电解池与燃料电池相组合的新工艺可使氯碱工业节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
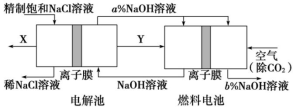
(1)图中X、Y分别是_______、______(填化学式),a ___b(填“>”、“<”或“=”)。
(2)燃料电池中负极的电极反应式是______________________。
(3)电解池中总反应的离子方程式是__________________________。
(4)假设该装置的能量利用率可达70%,要电解制得2.4 mol NaOH,燃料电池需消耗标准状况下的空气________L。(空气中O2的体积分数为20%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 实验室回收废水中苯酚的过程如图所示。下列分析错误的是( )

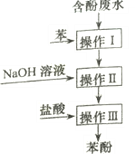
A. 操作Ⅰ中苯作萃取剂
B. 苯酚钠在苯中的溶解度比在水中的大
C. 通过操作Ⅱ苯可循环使用
D. 三步操作均需要漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题:绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下列是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法。

已知:室温下饱和 H2S溶液的 pH 约为3.9,SnS沉淀完全时溶液的 pH 为1.6;FeS开始沉淀时溶液的 pH 为3.0,沉淀完全时的 pH 为5.5。
(1) 操作Ⅱ,在溶液中用硫酸酸化至 pH=2的目的是_______________________。
(2)操作Ⅳ的顺序依次为________、________、过滤、洗涤、干燥。
(3)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②________________________________________________________________________。
(4)测定绿矾产品中Fe2+含量的方法是
a.称取一定质量的绿矾产品,配制成250.00 mL溶液;
b.量取25.00 mL 待测溶液于锥形瓶中;
c.用硫酸酸化的 0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
滴定时发生反应的离子方程式为5Fe2++MnO4-+8H+===5Fe3++Mn2++4H2O
①用硫酸酸化的 0.010 00 mol·L-1 KMnO4溶液滴定时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视锥形瓶中溶液颜色的变化判断此滴定实验达到终点的方法是___________________;
②若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有___ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某有机物A由C、H、O三种元素组成,90克A完全燃烧可生成132克CO2和54克H2O。
试求:
① 该有机物的最简式 。
② 若符合该最简式的A物质可能不止一种,则它们之间的关系 (填序号)
A.一定互为同系物 B.一定互为同分异构体
C.等质量的它们完全燃烧耗氧量相同 D.等物质的量的它们完全燃烧耗氧量相同
③ 若A的相对分子质量为180,每个碳原子上最多只有一个官能团,能发生银镜反应,也能发
生酯化反应,且所有碳原子在同一链上,则A的结构简式为 。
(2)有机物A(C10H20O2)具有兰花香味,可用作香皂、洗发香波的芳香赋予剂。
已知:

ⅰ.B分子中没有支链。
ⅱ.D能与碳酸氢钠溶液反应放出二氧化碳。ⅲ.D、E互为具有相同官能团的同分异构体。E分子烃基上的氢若被Cl取代,其一氯代物只有一种。ⅳ.F可以使溴的四氯化碳溶液褪色。
① B可以发生的反应有 (选填序号)。
a.取代反应 b.消去反应 c.加聚反应 d.氧化反应
② D、F分子所含的官能团的名称依次是 、 。
③ 写出与D、E具有相同官能团的一种同分异构体的结构简式__________________。
④ 写出B和E反应生成A的化学方程式是: 。
⑤ 写出C与银氨溶液反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1〈0
CH3OH(g) △H1〈0
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3〉0
CO(g)+H2O(g) △H3〉0
回答下列问题:
(1)反应①的化学平衡常数K的表达式为 ;图1中能正确反映平衡常数K随温度变化关系的曲线为 (填曲线标记字母),其判断理由是 。
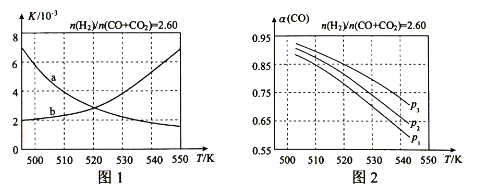
(2)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而 (填“增大”或“减小”),其原因是 。图2中的压强由大到小为_____,其判断理由是_____。
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0. 784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数, 其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)按要求回答下列有关问题。
(1)据报道,科学家新研发出一种常温下催化合成NH3的方法:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)
已知如下信息:
①化合物的生成热可以表示其相对能量。化学上,规定标准状况下稳定单质的生成热为0。几种物质的生成热:NH3(g)为mkJ·mol-1,H2O(l)为nkJ·mol-1。
反应的△H=产物的生成热之和---反应物的生成热之和
②几种化学键的键能数据如下:
![]()
上述反应中,△H=_______kJ·mol-1,H-N键的键能为_______kJ·mol-1。
(2)二氧化硫在一定条件下可以发生如下反应:
SO2(g)+NO2(g)![]() SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
SO3(g)+NO(g),△H= -42kJ·mol-1,在1L恒容密闭容器中充入SO2(g)和NO2(g),所得实验数据如下:
实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
N(SO2) | N(NO2) | N(NO) | ||
甲 | T1 | 0.80 | 0.20 | 0.18 |
乙 | T2 | 0.20 | 0.80 | 0.16 |
丙 | T3 | 0.20 | 0.30 | a |
①实验甲中,若2min时测得放出的热量是4.2kJ,则0~2min时间内,用SO2(g)表示的平均反应速率v(SO2)=_____________________;
②实验丙中,达到平衡时,NO2的转化率为____________;
③由表中数据可推知,Tl______T2(填“>”“<’’或“=”);
(3)对反应N2O4(g)![]() 2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
2NO2(g) △H>0 在温度为Tl、T2时平衡体系中NO2的体积分数随压强变化曲线如图所示,下列说法正确的是__________。
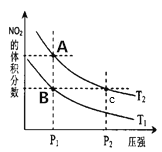
a.A、C两点的反应速率:A>C
b.A、C两点气体的颜色:A深,C浅
c.由状态A到状态B,可以用加热的方法
d.A、C两点的化学平衡常数:A=C
(4)工业上,采用石墨、铁棒作为电极,电解除去废水中的CN-(N为-3价,下同)
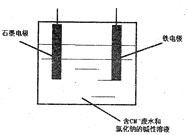
①铁电极应连接直流电源的____________(填写电极名称)。
②上述反应方程式配平后“□”内应填写________;
③阳极上发生的电极反应为2Cl--2e-=Cl2↑和_______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷![]() 具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:
具有高度的对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物I的一种合成路线:

回答下列问题:
(1)C的结构简式为 ,E的结构简式为 。
(2)③的反应类型为 ,⑤的反应类型为 。
(3)化合物A可由环戊烷经三步反应合成:

反应1的试剂与条件为 :反应2的化学方程式为 :
反应3可用的试剂为 。
(4)在I的合成路线中,互为同分异构体的化合物是 (填化合物代号)。
(5)I与碱石灰共热可转化为立方烷,立方烷的核磁共振氢谱中有 个峰。
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有 种。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com