
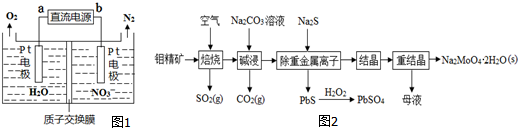
分析 (1)①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,说明该反应中生成氢氧根离子;
②根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,根据电池反应式知,阴极上硝酸根离子得电子生成氮气和水;
(2)灼烧钼精矿,MoS2燃烧,反应方程式为2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,碱性条件下,MoO3和Na2CO3溶液反应,反应方程式为MoO3+CO32-=MoO42-+CO2↑,然后向溶液中加入沉淀剂除去重金属离子,溶液中的溶质为Na2MoO4,将溶液蒸发浓缩、冷却结晶,然后重结晶得到Na2MoO4.2H2O,
①根据在化合物中正负化合价代数和为零,结合钼酸钠(Na2MoO4•2H2O)的化学式进行解答本题;
②焙烧时为了使钼精矿充分反应可以把钼精矿粉碎增大接触面积、或增大空气进入量,反应物接触时间越长,反应越充分;
③焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,元素化合价升高的失去电子发生氧化反应得到氧化产物,依据化学方程式定量关系计算电子转移物质的量;
④碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠;
⑤根据钼酸钡和硫酸钡的溶度积计算表示出溶液中硫酸根离子的浓度,再依据计算出SO42-的去除率计算得到溶度积.
解答 解:(1)①用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,说明该反应中生成氢氧根离子,同时还生成水,所以反应方程式为2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O,
故答案为:2NO3-+5H2$\frac{\underline{\;催化剂\;}}{\;}$N2+2OH-+4H2O;
②根据图象知,硝酸根离子得电子发生还原反应,则b为负极、a为正极,根据电池反应式知,阴极上硝酸根离子得电子生成氮气和水,电极反应式为2NO3-+12H++10e-=N2+6H2O,
故答案为:a;2NO3-+12H++10e-=N2+6H2O.
(2)①计算结晶水合物钼钼酸钠中元素的化合价只计算Na2MoO4中钼元素的化合价即可,钠元素显+1,氧元素显-2,设钼元素的化合价是x,根据在化合物中正负化合价代数和为零,可知钼酸钠(Na2MoO4•2H2O)中钼元素的化合价:(+1)×2+x+(-2)×4=0,则x=+6,
故答案为:+6;
②反应物接触时间越长,反应越充分,焙烧的过程中采用“逆流焙烧”的措施、粉碎矿石或增加空气通入量等,增大钼精矿与空气接触,使其充分反应,提高原料的利用率,
故答案为:将矿石粉碎(或增加空气的进入量或采用逆流原理等);
③焙烧过程中钼精矿发生的主要反应的化学方程式为:2MoS2+7O2$\frac{\underline{\;\;△\;\;}}{\;}$2MoO3+4SO2,元素化合价升高的失去电子发生氧化反应得到氧化产物,反应中Mo元素化合价+2价变化为+6价,硫元素化合价-1价变化为+4价,该反应中氧化产物是MoO3、SO2,反应中生成4mol二氧化硫电子转移28mol,则生成1mol二氧化硫电子转移为7mol,
故答案为:MoO3、SO2;7;
④碱性条件下,MoO3和Na2CO3溶液反应生成二氧化碳和钼酸钠,离子方程式为MoO3+CO32-=MoO42-+CO2↑,
故答案为:MoO3+CO32-=MoO42-+CO2↑;
⑤当BaMoO4开始沉淀时溶液中钡离子浓度c(Ba2+)=$\frac{Ksp(BaMnO{\;}_{4})}{c(MnO{\;}_{4}{\;}^{-})}$=$\frac{Ksp(BaMoO{\;}_{4})}{0.4mol/L}$,
溶液中硫酸根离子浓度c(SO42-)=$\frac{Ksp(BaSO{\;}_{4})}{c(Ba{\;}^{2+})}$,
SO42-的去除率为97.5%,1-$\frac{Ksp(BaSO{\;}_{4})}{c(Ba{\;}^{2+})}$=1-$\frac{1.0×10{\;}^{-10}}{\frac{Ksp(BaMoO{\;}_{4})}{0.4mol/L}}$=97.5%,所以Ksp(BaMoO4)=4.0×10-8,
故答案为:4.0×10-8.
点评 本题考查了物质分离和提纯的方法和基本操作综合应用,主要是电解原理、分离提纯的方法、物质性质的分析应用,溶度积常数的计算等知识,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 7.1g C12与足量NaOH溶液反应转移的电子数为0.2NA | |
| B. | 46 g NO2 和 N2O4混合气体中含有原子数为3NA | |
| C. | 1mol Na2O2 固体中含离子总数为4NA | |
| D. | 标准状况下,2.24L辛烷所含分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
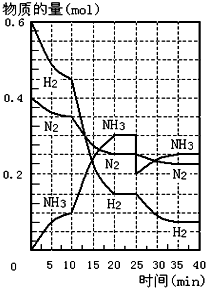 500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:
500℃、20MPa时,将H2和N2置于一容积为2L的密闭容器中发生反应.反应过程中H2、N2和NH3的物质的量变化如图所示,根据题意完成下列各题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 (s)浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 密度/(g•cm-3) | 熔点/℃ | 沸点/℃ | |
| 四氯化锡 | 2.2 | -33 | 114 |
| 金属锡 | 5.77 | 231 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,一定有化学键的断裂和形成 | |
| B. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 | |
| C. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| D. | 放热反应的反应速率,一定比吸热反应的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
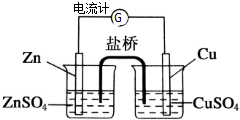 为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:
为了避免锌片与Cu2+直接接触发生反应而影响原电池的放电效率,有人设计了如图装置,按要求完成以下填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com