

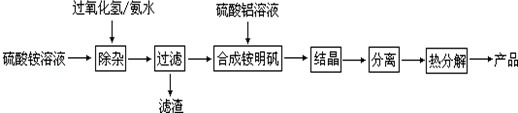
·ÖĪö £Ø1£©øł¾ŻĶ¼ÖŖ£¬ŃõĘųµĆµē×ÓÉś³ÉĒāŃõøłĄė×Ó”¢CuŹ§µē×ÓÉś³ÉĶĄė×Ó£¬·¢ÉśĪüŃõøÆŹ“£¬ŌņCu×÷øŗ¼«£»
£Ø2£©Cl-Ą©É¢µ½æ×æŚ£¬²¢ÓėÕż¼«·“Ó¦²śĪļŗĶøŗ¼«·“Ó¦²śĪļ×÷ÓĆÉś³É¶ąæ×·ŪדŠāCu2£ØOH£©3Cl£¬øŗ¼«ÉĻÉś³ÉĶĄė×Ó”¢Õż¼«ÉĻÉś³ÉĒāŃõøłĄė×Ó£¬ĖłŅŌøĆĄė×Ó·“Ó¦ĪŖĀČĄė×Ó”¢ĶĄė×ÓŗĶĒāŃõøłĄė×Ó·“Ӧɜ³ÉCu2£ØOH£©3Cl³Įµķ£»
£Ø3£©n[Cu2£ØOH£©3Cl]=$\frac{4.29g}{214.5g/mol}$=0.05mol£¬øł¾Ż×ŖŅʵē×Ó¼ĘĖćŃõĘųĪļÖŹµÄĮ棬ŌŁøł¾ŻV=nVm¼ĘĖćĢå»ż£®
½ā“š ½ā£ŗ£Ø1£©øł¾ŻĶ¼ÖŖ£¬ŃõĘųµĆµē×ÓÉś³ÉĒāŃõøłĄė×Ó”¢CuŹ§µē×ÓÉś³ÉĶĄė×Ó£¬·¢ÉśĪüŃõøÆŹ“£¬ŌņCu×÷øŗ¼«£¬¼“cŹĒøŗ¼«£¬
¹Ź“š°øĪŖ£ŗc£»
£Ø2£©Cl-Ą©É¢µ½æ×æŚ£¬²¢ÓėÕż¼«·“Ó¦²śĪļŗĶøŗ¼«·“Ó¦²śĪļ×÷ÓĆÉś³É¶ąæ×·ŪדŠāCu2£ØOH£©3Cl£¬øŗ¼«ÉĻÉś³ÉĶĄė×Ó”¢Õż¼«ÉĻÉś³ÉĒāŃõøłĄė×Ó£¬ĖłŅŌøĆĄė×Ó·“Ó¦ĪŖĀČĄė×Ó”¢ĶĄė×ÓŗĶĒāŃõøłĄė×Ó·“Ӧɜ³ÉCu2£ØOH£©3Cl³Įµķ£¬Ąė×Ó·½³ĢŹ½ĪŖ2Cu2++3OH-+Cl-=Cu2£ØOH£©3Cl”ż£¬
¹Ź“š°øĪŖ£ŗ2Cu2++3OH-+Cl-=Cu2£ØOH£©3Cl”ż£»
£Ø3£©n[Cu2£ØOH£©3Cl]=$\frac{4.29g}{214.5g/mol}$=0.02mol£¬øł¾Ż×ŖŅʵē×ÓµĆn£ØO2£©=$\frac{0.02mol”Į2”Į2}{4}$=0.02mol£¬V£ØO2£©=0.02mol”Į22.4L/mol=0.448L£¬
¹Ź“š°øĪŖ£ŗ0.448£®
µćĘĄ ±¾Ģāæ¼²éµÄŌµē³ŲŌĄķµÄÓ¦ÓĆ”¢ĪļÖŹµÄĮæµÄÓŠ¹Ų¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬×¢Ņā°ŃĪÕµē¼«µÄÅŠ¶ĻŅŌ¼°µē¼«ÉĻ·¢ÉśµÄ·“Ó¦£¬²ąÖŲÓŚæ¼²éѧɜ¶Ō»ł±¾ŌĄķµÄÓ¦ÓĆÄÜĮ¦ŗĶ¼ĘĖćÄÜĮ¦£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ė®ČÜŅŗÄܵ¼µē | B£® | ÓŠ½ĻøßµÄČŪµć | C£® | Ņ×ČÜÓŚĖ® | D£® | ČŪ»ÆŹ±Äܵ¼µē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 24Mg ŗĶ 24Na | B£® | O2 ŗĶ O3 | C£® | H2 ŗĶ D2 | D£® | 16O ŗĶ 18O |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ł¢Ś¢Ū | B£® | ¢Ś¢Ū¢Ü | C£® | ¢Ł¢Ś¢Ü | D£® | ¢Ū¢Ü¢Ż |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | NH3”¢CO”¢CO2¶¼ŹĒ¼«ŠŌ·Ö×Ó | |
| B£® | CH4”¢CCl4¶¼ŹĒŗ¬ÓŠ¼«ŠŌ¼üµÄ·Ē¼«ŠŌ·Ö×Ó | |
| C£® | NH3”¢PH3”¢AsH3µÄĪČ¶ØŠŌŗĶ·ŠµćĖę N”¢P”¢As µÄŗĖµēŗÉŹżµÄ±ä»ÆĒ÷ŹĘČēĶ¼ĖłŹ¾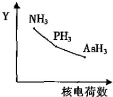 | |
| D£® | CS2”¢H2O”¢C2H2¶¼ŹĒÖ±ĻߊĶ·Ö×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | øĆ¾§ĢåŹōÓŚ·Ö×Ó¾§Ģ壬æÉÓĆ×÷ÖĘĄä²ÄĮĻ | |
| B£® | øĆ¾§ĢåÖŠĢ¼Ō×ÓŌŚæÕ¼äµÄ·Ö²¼½į¹¹Óė½šøÕŹÆĻąĖĘ | |
| C£® | øĆ¾§ĢåµÄČŪµćµĶÓŚ¶žŃõ»Æ¹č | |
| D£® | 1mol ¾§ĢåÖŠŗ¬ 4 mol C-O ¼ü |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | Ģå»ż¶¼ŹĒ22.4 L | B£® | ¾ßÓŠĻąĶ¬µÄĢå»ż | ||
| C£® | ¶¼ŹĒĖ«Ō×Ó·Ö×Ó | D£® | ¾ßÓŠĻąĶ¬µÄ·Ö×ÓŹżÄæ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ2016-2017Ń§ÄźÉ½Ī÷Ź”øßŅ»ÉĻ10ŌĀŌĀæ¼»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
NaCl”¢MgCl2”¢MgSO4µÄ»ģŗĻČÜŅŗÖŠ£¬c(Na+)=0.10 mol/L£¬c(Mg2+)= 0.25 mol/L£¬c(Cl- )=0.20 mol/L£¬Ōņc(SO42-)ĪŖ( )
A£®0.15 mol/L B£®0.l0 mol/L C£® 0.25 mol/L D£®0.20 mol/L
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com