

| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg•L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 取5mL 待测液,加入一定量的维生素C,振荡, 再加入1mL M溶液,加入至蒸馏水10mL,再振荡, 与④号色阶对比. | 紫红色比④色阶浅 | 维生素C 可以有效降低NaNO2的含量. |
分析 (1)金属铜和稀硝酸制得的一氧化氮中含有水,会和过氧化钠发生反应产生氧气,氧气极易把一氧化氮氧化;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,根据电子守恒配平方程式即可;
(3)硝酸具有挥发性,会干扰实验结果,据此回答分析;
(4)根据物质纯度计算公式纯度=$\frac{物质含量}{样品质量}$×100%;
(5)根据维生素C的作用以及要和(4)中的甲同学的实验方案形成对比试验,进行实验设计.
解答 解:(1)金属铜和稀硝酸制得的一氧化氮中含有水,水会和过氧化钠发生反应产生氧气,2Na2O2+2H2O=4NaOH+O2↑,生成的氧气极易把一氧化氮氧化为二氧化氮,即2NO+O2=NO2,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;2NO+O2=2NO2;
(2)高锰酸钾具有氧化性,能将一氧化氮氧化,反应的实质是:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O,
故答案为:5NO+3MnO4-+4H+=5NO3-+3Mn2++2H2O;
(3)由于获得一氧化氮所用的硝酸具有挥发性,这样会干扰实验结果,可以在A、B之间增加装有水的洗气瓶,减小实验误差,
故答案为:在A、B之间增加装有水的洗气瓶;
(4)甲待测液颜色与④号色阶相同,则甲同学制得的样品中NaN02的纯度是$\frac{60×10{\;}^{-3}g×100}{0.1g}$×100%=60%,
故答案为:60%;
(5)要和(4)中的甲同学的实验方案形成对比试验,同样可以是先取5mL待测液,然后加入维生素C,并加入1 mLM溶液,最后加入蒸馏水至10mL,若紫红色比③色阶浅,说明亚硝酸钠的含量低,则可以证明维生素C可以有效降低NaNO2的含量.
故答案为:维生素C;加入至蒸馏水10mL;紫红色比④色阶浅.
点评 本题是一道实验方案的设计和探究题,考查学生分析和解决问题的能力,综合性强,难度大.


科目:高中化学 来源: 题型:解答题
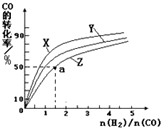 请运用化学反应原理的相关知识研究碳及其化合物的性质.
请运用化学反应原理的相关知识研究碳及其化合物的性质.| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
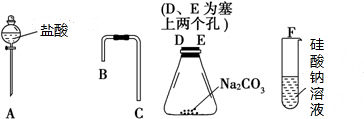
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图,一密闭气缸被一不漏气可滑动的活塞隔成两部分,左室充有氮气,右室充有混合气体.在室温下将右室的气体点燃,反应后冷却至原室温,活塞最终静止于气缸的某一点(液体体积忽略不计).
如图,一密闭气缸被一不漏气可滑动的活塞隔成两部分,左室充有氮气,右室充有混合气体.在室温下将右室的气体点燃,反应后冷却至原室温,活塞最终静止于气缸的某一点(液体体积忽略不计).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | Ⅵ | VⅡA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
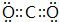 ,写出它的一种用途做灭火剂等.
,写出它的一种用途做灭火剂等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
蛇纹石可以看作由MgO、Fe2O3、Al2O3、SiO2组成.实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)═2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可通过蒸馏的方法除去自来水中含有的氯离子等杂质制蒸馏水 | |
| B. | 将氢氧化钠稀溶液逐滴滴入氯化铁饱和溶液中,边滴边搅拌,可获得氢氧化铁胶体 | |
| C. | 由于氢氧化铁胶体带正电,所以电泳时阴极颜色加深 | |
| D. | 浓硫酸不慎溅到皮肤上,应该立即用大量水冲洗,然后涂上稀NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com