
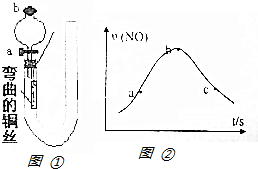
 如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题:
如图①是某化学兴趣小组同学设计的研究铜和稀硝酸反应速率[v(NO)]的实验装置图.试回答下列问题:分析 (1)Cu与稀硝酸反应生成硝酸铜、NO与水;
(2)为测定铜和稀硝酸反应速率[v (NO)],应测定单位时间内生成NO的体积;
(3)液封气体使U形管两侧形成液面高度差,一段时间内液面高度差保持不变,说明气密性良好;
(4)要防止NO被氧气氧化,用加入的稀硝酸排尽装置中空气;反应开始记录时间,反应完毕测定NO体积;
(5)温度与硝酸的浓度影响反应速率,开始阶段温度起主导作用,反应进行一段时间后,体系温度变化不大,硝酸浓度起主导作用.
解答 解:(1)铜和稀硝酸反应生成硝酸铜、一氧化氮和水,反应方程式为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O;
(2)为测定铜和稀硝酸反应速率[v (NO)],应测定单位时间内生成NO的体积,需要测定NO的体积和反应时间,
故答案为:NO的体积、反应时间;
(3)实验前检验装置的气密性:关闭分液漏斗盖b和活塞a,从U形管长管处置水至管长管中液面高于短管中液面,过一会,若液面差保持不变,则装置气密性良好,
故答案为:关闭分液漏斗盖b和活塞a,从U形管长管处置水至管长管中液面高于短管中液面,过一会,若液面差保持不变,则装置气密性良好;
(4)打开分液漏斗盖b和活塞a,从U形管右端注入稀硝酸至排尽左端空气,关闭活塞a,再将弯曲的铜丝迅速伸入溶液并开始记录时间,
故答案为:打开分液漏斗盖b和活塞a,从U形管右端注入稀硝酸至排尽左端空气,关闭活塞a;记录时间;
①a→b,反应速率加快,是因为铜和稀硝酸反应是放热反应,体系温度升高,反应速率加快,
故答案为:铜和稀硝酸反应是放热反应,体系温度升高,反应速率加快;
②b→c,化学反应速率减慢,是因为反应进行一段时间后,体系与环境的温差大,散热加快,体系温度变化不大甚至有所下降,c(HNO3)降低,反应速率降低,
故答案为:反应进行一段时间后,体系与环境的温差大,散热加快,体系温度变化不大甚至有所下降,c(HNO3)降低,反应速率降低.
点评 本题考查反应速率探究实验,关键是对原理的理解,掌握影响化学反应速率的因素,题目难度中等.


科目:高中化学 来源: 题型:解答题
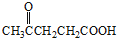 )合成聚芳酯E的路线(省略部分产物):
)合成聚芳酯E的路线(省略部分产物):
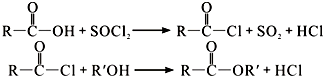
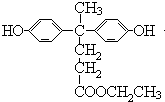
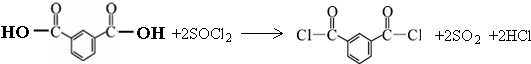 .
. 的路线.
的路线. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
. 的合成路线(无机原料任选).
的合成路线(无机原料任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )
屠呦呦因对青蒿素的研究而获得诺贝尔生理学或医学奖,青蒿素可以青蒿酸(结构简式如图所示)为原料合成,下列关于青蒿酸的说法中正确的是( )| A. | 分子式为C15H24O2 | B. | 属子芳香族化合物 | ||
| C. | 能发生取代反应和加成反应 | D. | 分子中所有原子可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
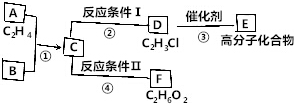 已知:
已知: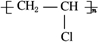 ,FCH2OHCH2OH.
,FCH2OHCH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①③ | C. | ②③ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 甲 | 乙 | 丙 |
| 样品质量(g) | 9.6 | 12.8 | 64.0 |
| 气体体积(L) | 5.04 | 6.72 | V |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Z元素的最高价氧化物对应的水化物酸性强于Y元素的最高价氧化物对应的水化物 | |
| B. | X、Y、Z形成的简单离子的半径大小:Yn->Zm->Xm- | |
| C. | 元素Z、Y分别与元素W形成的化合物的热稳定性:WmZ<WnY | |
| D. | 若HnY溶液的酸性比HmZ溶液的酸性强,则Y的非金属性比Z的强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com