
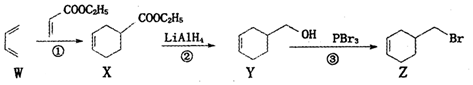
| A. | 烯烃W名称为1,3-丁二烯,所有原子一定在同一平面上 | |
| B. | ①、②、③的反应类型依次为加成反应、还原反应和取代反应 | |
| C. | 由化合物Z-步制备化合物Y的转化条件是:NaOH醇溶液,加热 | |
| D. | 化合物Y先经酸性髙锰酸鉀溶液氧化,再与乙醇在浓硫酸催化下酯化可得化合物X |
分析 1,3-丁二烯与丙烯酸乙酯发生加成反应生成X,X发生还原反应生成Y,Y发生取代反应生成Z;
A.W含2个双键,共4个C,且双键直接相连;
B.结合官能团的变化判断;
C.由化合物Z一步制备化合物Y,应发生水解反应;
D.Y含有碳碳双键,可被酸性高锰酸钾氧化.
解答 解:A.烯烃W含2个双键,共4个C,名称为1,3-丁二烯,且双键直接相连,所有原子一定在同一平面上,故A正确;
B.由官能团的转化可知1,3-丁二烯与丙烯酸乙酯发生加成反应生成X,X发生还原反应生成Y,Y发生取代反应生成Z,故B正确;
C.由化合物Z一步制备化合物Y,应发生水解反应,应在氢氧化钠的水溶液中加热,故C错误;
D.Y含有碳碳双键、-OH,均可被酸性高锰酸钾氧化,故D错误.
故选AB.
点评 本题考查有机物的合成,为高频考点,注意根据结构与反应条件进行推断,侧重考查学生的分析推理能力、知识迁移运用能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

| 实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
| A | B | 消耗体积(mL) | ||
| 1 | 20.00 | 22.05 | ||
| 2 | 20.00 | 21.34 | ||
| 3 | 20.00 | 21.30 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6 LNO和5.6LO2混合后的分子总数为0.5 NA | |
| B. | 1mol乙烷分子含有8NA个共价键 | |
| C. | 58.5 g氯化钠固体中含有NA个氯化钠分子 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部 | B. | (1)(2)(3)(4) | C. | (1)(2)(3) | D. | (2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论 | |
| A | 将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多 | 乙醇羟基中的氢原子不如水分子中的氢原子活泼 |
| B | 在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色 | 石蜡油的分解产物中含有烯烃 |
| C | 向盛有Na2CO3固体的锥形瓶中滴加稀盐酸,产生无色气体 | 不能证明氯元素的非金属性强于碳元素 |
| D | 向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀 | 蔗糖未水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验②证明了①的滤液中含有Ag+,由此推断①的滤液中也含有Cl- | |
| B. | 实验②证明了Kap(AgCl)<Kap(Ag2SO4) | |
| C. | 实验③的溶液中含有+微粒 | |
| D. | 由实验③推测:若在①的沉淀中滴加NaOH溶液,沉淀也能溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操作步骤 | 实验现象 | 结论 |
| 取少量1中溶液于试管甲中,滴加品红溶液和盐酸. | 品红始终不褪色 | ①无SO2(或HSO3-或SO32-)生成 |
| 另取少量1中溶液于试管乙中,加入Ba(OH)2溶液,振荡 | ②白色沉淀 | 有SO42-生成 |
| ③继续在试管乙中滴加Ba(OH)2 溶液至过量,静置,取上层清液于试管中,加入足量稀硝酸酸化的硝酸银溶液. | 有白色沉淀生成 | 有Cl-生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入过量Cl2:Cl-、SO42-、Fe2+、Al3+ | |
| B. | 加入过量NaOH溶液:SO42-、Na+、AlO2-、OH- | |
| C. | 加入过量氨水:NH4+、SO42-、Na+、AlO2- | |
| D. | 加入过量NaNO3溶液:NO3-、SO42-、Fe2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | V=224 | |
| B. | 样品中Fe的质量为2.14 g | |
| C. | 未氧化前Fe元素的质量分数约为41.2% | |
| D. | 样品中CuO的质量为3.52 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com