
| 物质 | 开始沉淀pH | 沉淀完全pH |
| Fe(OH)3 | 2.2 | 3.2 |
| Cu(OH)2 | 5.6 | 6.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| 1 | 2 | 3 | |
| 空白实验消耗硫酸铈标准溶液的体积(mL) | 0.75 | 0.50 | 0.80 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.75 | 24.85 | 24.80 |
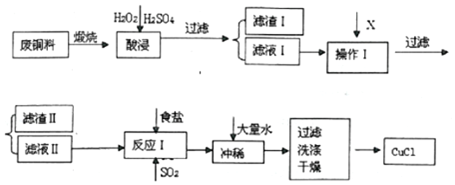
分析 废铜料(含Fe、Al及其化合物、SiO2杂质),生产CuCl:煅烧废铜料,将铜转化为溶于酸的氧化物,再加入过氧化氢和稀硫酸,二氧化硅不溶,金属离子进入溶液,过滤,则滤渣Ⅰ为二氧化硅,滤液Ⅰ为铁离子、铝离子、铜离子的溶液,向滤液中加入X得到沉淀,应为将铁离子、铝离子除杂,故X可为CuO、Cu(OH)2、Cu2(OH)2CO3、Cu,调节pH4.7~5.6,沉淀铁离子、铝离子,滤渣Ⅱ为氢氧化铁、氢氧化铝,滤液Ⅱ为铜离子的溶液,加入食盐并通入SO2发生反应:2H2O+2Cu2++SO2+4Cl-=2CuCl2-+SO42-+4H+,生成CuCl2-,CuCl2-的溶液用水稀释后可生成CuCl沉淀,过滤、洗涤、干燥得到产品,据此分析;
(6))①玻璃珠的作用是使反应物混合均匀,急速样品溶解;
④依据方程式中各反应物量之间的关系计算CuCl的纯度.
解答 解:(1)酸浸液中加入足量H2O2的主要目的是将Fe2+完全氧化为Fe3+,便于转化为Fe(OH)3沉淀除去;
故答案为:将Fe2+完全氧化为Fe3+,便于转化为Fe(OH)3沉淀除去;
(2)二氧化硅不溶于酸,故滤渣Ⅰ为二氧化硅;
故答案为:SiO2;
(3)操作I调节溶液的pH目的是将铁离子、铝离子除去,而不能使铜离子沉淀,由表可知pH范围为:4.7≤pH≤5.6;X调节pH,为了不引入新的杂质,X可用CuO、Cu(OH)2、Cu2(OH)2CO3、Cu;
故答案为:4.7≤pH≤5.6;ABCD;
(4)往滤液II为铜离子的溶液,加入食盐并通入SO2可生成CuCl2-,铜元素化合价降低,则硫元素化合价升高为硫酸根离子,故离子方程式为:2H2O+2Cu2++SO2+4Cl-=2CuCl2-+SO42-+4H+;
故答案为:2H2O+2Cu2++SO2+4Cl-=2CuCl2-+SO42-+4H+;
(5)乙醇易挥发,CuCl易被氧化,于70℃真空干燥的目的是加快乙醇和水的蒸发,防止CuCl被空气氧化;
故答案为:加快乙醇和水的蒸发,防止CuCl被空气氧化;
(6)①玻璃珠的作用是使反应物混合均匀,急速样品溶解;
故答案为:加速样品的溶解;
④根据题目中所给数据及平行实验结果相差不能超过0.3%,第二组实验数据舍去,滴定0.25g样品消耗硫酸铈标准溶液的平均体积为24.00mL,根据CuCl+FeCl3═CuCl2+FeCl2,Fe2++Ce4+=Fe3++Ce3+,
CuCl~Ce4+,CuCl的纯度=$\frac{24×1{0}^{-3}L×0.1mol/L×99.5g/mol}{0.25g}×100%$=95.52%;
故答案为:95.52%.
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、物质含量测定等,需要学生具备扎实的基础,题目难度中等.


 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 12 | C. | 24 | D. | 28 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅胶有吸水性,是常用的食品干燥剂 | |
| B. | 铝制餐具不能长时间存放酸性、碱性或咸的食物 | |
| C. | 瓷器中含有大量的金属元素,因此陶瓷属于金属材料 | |
| D. | NaCl可以用作调味品和食品防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
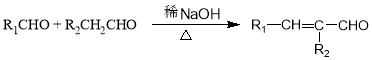
 (R为烃基),其中一种辣椒素酯类化合物J的合成路线如图:
(R为烃基),其中一种辣椒素酯类化合物J的合成路线如图: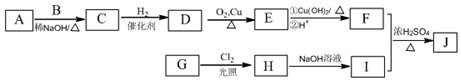
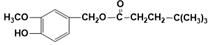 .
.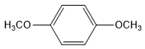 (写结构简式).
(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
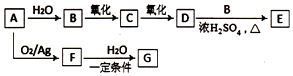 A是一种重要的化工原料,C、F的分子式都为C2H4O,F是没有不饱和键的环状有机物,G的分子式为C2H6O2,G中含有两个相同的官能团,转化关系如图:
A是一种重要的化工原料,C、F的分子式都为C2H4O,F是没有不饱和键的环状有机物,G的分子式为C2H6O2,G中含有两个相同的官能团,转化关系如图: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com