
【题目】锂/磷酸氧铜电池是一种以磷酸氧铜作为正极材料的锂离子电池,其正极的活性物质是Cu4O(PO4)2,制备流程如下:

主要反应原理:2Na3PO4+4CuSO4+2NH3·H2O===Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1) 实验室进行“过滤”操作使用的玻璃仪器主要有____________________。
(2) 流程中“洗涤Ⅰ”后,检验沉淀已洗涤干净的方法是__________________。
(3) 准确称取上述流程所得的样品38.56 g [假定样品中只含Cu4O(PO4)2和CuO两种物质],使其完全溶于一定量的硝酸中,再加入氢氧化钠溶液,使铜完全沉淀,将沉淀灼烧使其转变为黑色氧化铜,最终称得残留固体质量为27.20 g。计算所得样品中磷酸氧铜的质量分数_______。(写出计算过程)
【答案】漏斗、烧杯、玻璃棒 取最后一次洗涤后的滤液少许于干净的试管中,滴加BaCl2溶液,若溶液不变浑浊,则沉淀已经洗净 n(CuO)×80 g·mol-1+n[Cu4O(PO4)2]×462 g·mol-1=38.56 g
n(CuO)+4n[Cu4O(PO4)2]=27.20 g÷80 g·mol-1
解得n(CuO)=0.02 mol、n[Cu4O(PO4)2]=0.08 mol
w[Cu4O(PO4)2]=0.08 mol×462 g·mol-1÷38.56 g×100%=95.85%
【解析】
(1)过滤操作使用的玻璃仪器有漏斗、烧杯、玻璃棒;
(2)反应后溶液中存在SO42-,固体应吸附SO42-离子,可通过检验SO42-的方法检验沉淀是否洗涤干净;
(3)由样品质量和灼烧得到氧化铜质量建立联立方程,解得磷酸氧铜的物质的量,再计算所得样品中磷酸氧铜的质量分数。
(1)实验室进行“过滤”操作使用的玻璃仪器有漏斗、烧杯、玻璃棒,故答案为:漏斗、烧杯、玻璃棒;
(2)反应后溶液中存在SO42-,固体应吸附SO42-离子,可通过检验SO42-的方法检验沉淀是否洗涤干净,具体做法是取最后一次洗涤的流出液,向其中加入氯化钡溶液,若无白色沉淀,说明已经洗涤干净,故答案为:取最后一次洗涤后的滤液少许于干净的试管中,滴加BaCl2溶液,若溶液不变浑浊,则沉淀已经洗净;
(3)由题意样品38.56g,则有n(CuO)×80 g·mol-1+n[Cu4O(PO4)2]×462 g·mol-1=38.56 g①,由最终称得残留固体质量为27.20 g,则有n(CuO)+4n[Cu4O(PO4)2]=27.20 g÷80 g·mol-1②,解联立①②得n(CuO)=0.02 mol、n[Cu4O(PO4)2]=0.08 mol,故w[Cu4O(PO4)2]=0.08 mol×462 g·mol-1÷38.56 g×100%=95.85%,故答案为:95.85%。


 同步轻松练习系列答案
同步轻松练习系列答案科目:高中化学 来源: 题型:
【题目】(1)①在BF3分子中,F—B—F的键角是________,B原子的杂化轨道类型为________,BF3和过量NaF作用可生成NaBF4,BF![]() 的立体构型为________;
的立体构型为________;
②在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(2)①Y2X2(C2H2)分子中Y原子轨道的杂化类型为______,1 mol Y2X2含有σ键的数目为______。
②元素Y(C)的一种氧化物与元素Z(N)的一种氧化物互为等电子体,元素Z的这种氧化物的分子式为________。
③化合物ZX3(NH3)的沸点比化合物YX4(CH4)的高,其主要原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是重要的化工原料,也是清洁的能源。
Ⅰ、工业上,在一定条件下用乙烯水化法制备乙醇。已知热化学方程式如下:
①CH2=CH2(g)+H2O(g)CH3CH2OH(g) ΔH1
②2CH2=CH2(g)+H2O(g)CH3CH2OCH2CH3(g) ΔH2
③2CH3CH2OH(g)CH3CH2OCH2CH3(g)+H2O(g) ΔH3
(1)几种化学键的键能如下:
化学键 | H-C | C=C | H-O | C-O | C-C |
键能kJ·mol-1 | 413 | 615 | 463 | 351 | 348 |
根据键能计算ΔH1=________________kJ·mol-1。
(2)在恒容密闭容器中发生反应②,下列能说明该反应达到平衡的是_________。
a、容器中总压强保持不变
b、H2O(g)的消耗速率与CH3CH2OCH2CH3(g)生成速率相等
c、气体平均摩尔质量保持不变
d、容器中气体密度保持不变
(3)在密闭容器中投入CH2=CH2(g)、H2O(g)和催化剂发生反应①,乙烯的平衡转化率与温度、压强的关系如图所示。

①x代表________________。(选填“温度”或“压强”)
②L1和L2哪个大?并请说出理由:_____________________________________________________。
Ⅱ、如图所示,甲、乙之间的隔板K和活塞F都可左右移动,甲中充入2molA和1molB,乙中充入2molC和lmolHe,此时K停在0处。在一定条件下发生可逆反应:2A(g)+B(g)2C(g);反应达到平衡后,再恢复至原温度。回答下列问题:

(4)达到平衡时,隔板K最终停留在0刻度左侧某一处,记为a处,则a的取值范围是__________。
(5)若达到平衡时,隔板K最终停留在左侧刻度1处,此时甲容积为2L,则该反应化学平衡常数为_______________。
(6)若一开始就将K、F如上图固定,其他条件均不变,则达到平衡时:测得甲中A的转化率为b,则乙中C的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。由此分析,该反应的化学方程_____________________________________;从反应开始至2 min,Z的反应速率为_____ mol·L-1·min-1。

(2)若上述反应的△H<0,下列有关该反应速率的叙述,正确的是_________。
A.升高温度和增大压强均可以增大活化分子百分数,加快反应速率
B.使用催化剂可以使反应的活化能降低,加快反应速率
C.活化分子间所发生的碰撞为有效碰撞
D.降低温度,v正、v逆均减小且v正减小的倍数小于v逆减小的倍数
(3)在一密闭容器中发生反应N2(g)+3H2(g)![]() 2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
2NH3(g)△H<0,达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示。 t1、t3、t4时刻分别改变的一个条件是:
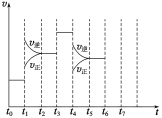
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加催化剂 F.充入氦气
t1时刻________;t3时刻________;t4时刻________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于氧化还原反应的是( )
A. S+O 2 ![]() SO2
SO2
B. Fe(OH)3+3HCl===FeCl3+3H2O
C. 2Mg+CO2![]() 2MgO+C
2MgO+C
D. 4HNO3(浓)![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 糖类都是天然高分子化合物,组成与结构比较复杂
B. 可以用酸性高錳酸鉀溶液鉴别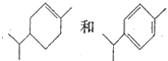
C. 体积分数为90%的乙醇溶液能使蛋白质变性,常用于医疗消毒
D. 甲苯的一溴代物和2一甲基丁烷的一溴代物都有4种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是

A. 好氧微生物反应器中反应为:NH4++2O2==NO3-+2H++H2O
B. B极电势比A极电势低
C. A极的电极反应式CH3COO-+8e-+2H2O==2CO2+7H+
D. 当电路中通过1mol电子时,理论上总共生成2.24LN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿石是制取硫酸的主要原料,主要成分为FeS2和少量FeS(假设其它杂质中不含铁、硫元素,且高温下不发生化学变化)。某化学兴趣小组对该黄铁矿石进行如下实验探究。将m1g该黄铁矿石的样品放入如图装置(夹持和加热装置略)的石英管中,从a处不断地缓缓通入空气,高温灼烧黄铁矿样品至反应完全。其反应的化学方程式为4FeS2+11O2=2Fe2O3+8SO2,4FeS+7O2=2Fe2O3+4SO2

(1)鼓人空气的作用是___________,锥形瓶乙中NaOH溶液的作用是___________。
(实验一)测定硫元素的含量
反应结束后,将乙瓶中的溶液进行如下处理:

(2)反应结束后,给乙瓶溶液中加入足量H2O2溶液的目的是___________(用化学方程式表示)。
(3)洗涤滤渣的方法是______________________。
(4)该黄铁矿石中硫元素的质量分数为___________(列出表达式即可)。
(实验二)测定铁元素的含量
①用足量稀硫酸溶解石英管中的固体残渣;②加还原剂使溶液中的Fe3+恰好完全转化为Fe2+后,过滤、洗涤;③将滤液稀释至250mL;④取25.00mL稀释液,用0.1000mol·L-1的酸性KMnO4溶液滴定,三次滴定实验,平均消耗酸性KMnO4溶液25.00mL。
(5)操作②中用铁粉作还原剂,测定铁的含量___________(填“偏高”或“偏低”或“不变”),操作④中滴定时酸性KMnO4溶液盛装在___________填“酸式滴定管”或“碱式滴定管”),③中稀释液中Fe2+的物质的量浓度c(Fe2+)=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应I2(g)+H2(g) ![]() 2HI(g) ΔH<0,下列说法正确的是( )
2HI(g) ΔH<0,下列说法正确的是( )
A.降低温度,正向反应速率减小倍数大于逆向反应速率减小倍数
B.升高温度将缩短达到平衡的时间
C.达到平衡后,保持温度和容积不变,充入氩气,正、逆反应速率同等倍数增大
D.达到平衡后,保持温度和压强不变,充入氩气,HI的质量将减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com