
| A. | 光导纤维、合成纤维和人造纤维都是有机高分子化合物 | |
| B. | 合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 | |
| C. | H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
分析 A、相对分子质量在10000以上的有机化合物为高分子化合物;
B、合金中可能含有非金属元素;
C、高锰酸钾的氧化性比过氧化氢的氧化性强;
D、地沟油的主要成分为油脂,油脂为高级脂肪酸甘油酯;据此解答即可.
解答 解:A、光导纤维的成分是二氧化硅,不是高分子化合物,故A错误;
B、合金是由两种或两种以上的金属与金属(或非金属)经一定方法所合成的具有金属特性的物质.合金材料中一定有金属,也可能含有非金属元素,故B正确;
C、高锰酸钾的氧化性比过氧化氢强,与高锰酸钾溶液反应应是过氧化氢被氧化生成水,故C错误;
D、地沟油的主要成分为油脂,油脂为高级脂肪酸甘油酯,分馏是物理变化,不可能得到汽油、煤油,故D错误,故选B.
点评 本题考查较为综合,涉及高分子化合物概念、油脂的性质、氧化还原氧化剂氧化性强弱判断等知识,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,难度不大,注意相关知识的积累.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

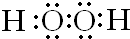 ,C元素在周期表中的位置是第二周期、第ⅦA族.
,C元素在周期表中的位置是第二周期、第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-二氯丙烷 | B. | 1,1-二氯丙烷 | C. | 1,2-二氯丙烷 | D. | 2,2-二氯丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 | |
| B. | 20℃时,氨基甲酸铵的分解平衡常数为2.048×10-9mol3•L-3 | |
| C. | 恒温下压缩体积,NH3的体积分数不变 | |
| D. | 再加入一定量氨基甲酸铵,可加快正反应反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 容器 | c(CO2) | c(H2) | c(CH3OCH3) | c(H2O) | v(正)和v(逆)大小比较 |
| I | 1.0×10-2 | 1.0×10-2 | 1.0×10-4 | 1.0×10-4 | v(正)=v(逆) |
| Ⅱ | 2.0×10-2 | 1.0×10-2 | 1.0×10-4 | 2.0×10-4 | v 正)< v(逆)(填>、<、=) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷、丁烯 | B. | 乙炔、丙烷 | C. | 乙烷、乙烯 | D. | 乙炔、乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能和NaOH溶液反应 | |
| B. | 甲苯与液溴,铁作催化剂的反应 | |
| C. | 甲苯能被酸性高锰酸钾氧化 | |
| D. | 1mol邻二甲苯与3mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com