
| A、NaHCO3=Na++HCO3- |
| B、Na2SO4=2Na++SO4-2 |
| C、Ca(NO3)2=Ca2++2(NO3)2- |
| D、KClO3=K++Cl-+3O2- |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 |
| B、加水稀释到原体积的10倍后溶液pH变为4 |
| C、加入少量乙酸钠固体,溶液pH升高 |
| D、溶液中粒子浓度大小关系为:c(H+)>c(CH3COOH)>c(CH3COO-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B、乙与氧气的摩尔质量相同,则乙属于分子晶体,其沸点一定和氧气相近 |
| C、丙中含有第二周期IVA族的元素,则丙一定是甲烷的同系物 |
| D、丁和甲中各元素质量比相同,则1mol 丁分子含有3NA个共用电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14 g氮气所含原子数为NA |
| B、1 mol 水中所含电子数为10NA |
| C、32gO2与32gO3所含原子数分别为2NA和3NA |
| D、0.5 molNa2CO3与1.5mol H2O所含氧原子数目均为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18g NH4+ 所含质子数为10NA |
| B、常温常压下,NA个氢分子的质量为1g |
| C、2mol金属铝与足量的盐酸反应,共失去了4NA个电子 |
| D、在同温同压时,相同体积的任何气体单质所含的分子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
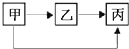
| 物质 选项 | 甲 | 乙 | 丙 |
| A | CuO | CO2 | H2O |
| B | C | CO | CO2 |
| C | CaCO3 | CaO | Ca(OH)2 |
| D | H2SO4 | H2O | H2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com