
分析 (1)依据钠完全反应计算反应电子转移;
(2)铝和铁都能把位于其后的金属从其盐溶液中置换出来,但铝的活泼性强于铁,铝先与盐溶液反应,然后铁与与盐溶液反应;
(3)计算氧元素质量分数,根据化学式中元素质量之比列方程计算;
(4)根据溶液中含有硝酸,所以铁元素以Fe3+的形式存在,根据电荷守恒c(H+)+2c(Cu2+)+3c(Al3+)+3c(Fe3+)=c(NO3-),据此计算c(Fe3+),进而计算n(Fe3+),再根据Fe元素守恒计算原混合物中Fe的质量.
解答 解:(1)一定条件下4.6g Na完全与O2反应生成7.2g产物,依据钠失电子计算得到,失去的电子数为0.2NA,故答案为:0.2NA;
(2)a.铝粉氯化铜溶液反应生成氯化亚铁和铜,不可能生成Fe3+,故a错误;
b.铝先与氯化铜溶液反应,然后铁与氯化铜溶液反应,只要铝剩余,铁与氯化铜溶液就不反应,溶液中就不可能含有Fe2+,故b错误;
c.铝粉、铁粉都全部与溶液反应,且溶液过量,溶液中有Cu2+、Fe2+、Al3+,不溶物为Cu,故c正确;
d.铝粉部分与溶液反应、铁粉与溶液未反应,溶液中有Fe2+、Al3+,不溶物为Cu、Fe,故d正确;
故选:cd;
(3)铁的某种氧化物的化学式表示为Fex0(x<1),铁元素在该氧化物中的质量分数为75%,则氧元素质量分数为25%,故56x:16=75%:25%,解得x=0.86,
故答案为:0.86;
(4)溶液中含有硝酸,所以铁元素以Fe3+的形式存在,溶液中的电荷守恒:c(H+)+2c(Cu2+)+3c(Al3+)+3c(Fe3+)=c(NO3-),即 0.5mol/L+0.3mol/L×2+0.2mol/L×3+3c(Fe3+)=2mol/L,解得:c(Fe3+)=0.1mol/L,n(Fe3+)=0.1mol/L×1L=0.1mol,故m(Fe)=0.1mol×56g/mol=5.6克,
故答案为:5.6.
点评 本题考查的知识点较多,涉及元素化合物性质、混合物计算等知识点,侧重于学生的分析能力的考查,题目难度中等.注意溶液中的电荷守恒的应用.


科目:高中化学 来源: 题型:选择题
| A. | Na2 C03溶液呈碱性:C032-+2H20?H2C03+20H- | |
| B. | NaHC03溶液中加过量Ca(OH)2溶液:Ca2++20H-+2HC03-═CaC03++C032-+2H2O | |
| C. | 漂白粉溶液中通入足量二氧化硫气体:ClO-+SO2+H2O═HC1O+HSO3- | |
| D. | 向NaAl02溶液中通入过量C02:AlO2-+CO2+2H2O═Al(OH)3+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一项 | B. | 二项 | C. | 三项 | D. | 四项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | X | Y |
| A | Al | NaOH溶液 |
| B | NO2 | H2O |
| C | Na2O2 | CO2 |
| D | Cu | 浓HNO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3使湿润的红色石蕊试纸变蓝 | |
| B. | 向硅酸钠溶液中滴加适量稀盐酸,有透明的凝胶形成 | |
| C. | 将氯水长期放置,黄绿色消失 | |
| D. | 向Fe2(SO4)3溶液中滴加NaOH溶液,生成红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.25 | B. | 0.1 | C. | 0.5 | D. | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
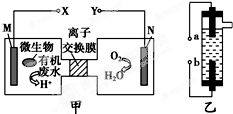
| A. | 装置甲可以在高温环境中工作 | |
| B. | 装置甲中N极发生的电极反应为O2+4H++4e-═2H2O | |
| C. | 装置乙中b极的电极反应式为2H++2e-═H2↑ | |
| D. | 装置乙的a极要与装置甲的Y极连接 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x<y | B. | x=y | C. | x>y | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com