
【题目】300℃时,将2molA和2molB两种气体混合于2L密闭容器中,发生如下发应:3A(g)+B(g) ![]() 2C(g)+2D(g);△H=Q.2min末达到平衡,生成0.8mol D.
2C(g)+2D(g);△H=Q.2min末达到平衡,生成0.8mol D.
(1)300℃时,该反应的平衡常数表达式为:K= . 已知K300℃<K350℃ , 则△H0(填“>”或“<”).
(2)在2min末时,B的平衡浓度为 , D的平均反应速率为 .
(3)若温度不变,缩小容器容积,则A的转化率(填“增大”、“减小”或“不变”),原因是 .
(4)如果在相同的条件下,上述反应从逆反应方向进行,开始时若加入C、D各 ![]() mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入Bmol.
mol.若使平衡时各物质的物质的量浓度与原平衡相同,则还原该加入Bmol.
【答案】
(1) ;>
;>
(2)0.8mol/L;0.2mol/(L?min)
(3)不变;反应前后气体体积不变,压强对平衡无影响
(4)![]()
【解析】解:对于反应
3A(g)+ | B(g) | 2C(g)+ | 2D(g) | |
起始(mol) | 2 | 2 | 0 | 0 |
转化(mol) | 1.2 | 0.4 | 0.8 | 0.8 |
平衡(mol) | 0.8 | 1.6 | 0.8 | 0.8 |
;(1)化学平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则K= ![]() ,K300℃<K350℃,说明升高温度平衡向正反应方向移动,则正反应放热,△H>0,
,K300℃<K350℃,说明升高温度平衡向正反应方向移动,则正反应放热,△H>0,
所以答案是: ![]() ;>;(2)由上述计算可知,平衡时B的物质的量为1.6mol,所以B的平衡浓度为c(B)=
;>;(2)由上述计算可知,平衡时B的物质的量为1.6mol,所以B的平衡浓度为c(B)= ![]() =0.8mol/L,
=0.8mol/L,
平衡时D的物质的量为0.8mol,所以用D表示的平均反应速率为v(D)= ![]() =0.2mol/(Lmin),
=0.2mol/(Lmin),
所以答案是:0.8mol/L;0.2mol/(Lmin);(3)由方程式可知,气体的化学计量数之和前后相等,则反应前后气体体积不变,压强对平衡无影响,缩小容器容积,则A的转化率不变,
所以答案是:不变;反应前后气体体积不变,压强对平衡无影响;(4)为等效平衡,应前后气体体积不变,按化学计量数转化到左边,满足n(A):n(B)=1:1即可.
根据3A(g)+B(g) ![]() 2C(g)+2D(g)可知,C和D各
2C(g)+2D(g)可知,C和D各 ![]() mol,转化到左边可得A、2mol,B、
mol,转化到左边可得A、2mol,B、 ![]() mol.
mol.
令B的物质的量为nmol,则:2mol:(n+ ![]() )mol=2mol:2mol,解得n=
)mol=2mol:2mol,解得n= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】关于本题考查的化学平衡的计算,需要了解反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能得出正确答案.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】X是一种具有果香味的合成香料,如图为合成X的某种流程: 
已知:Ⅰ. ![]() 不能最终被氧化为﹣COOH;
不能最终被氧化为﹣COOH;
Ⅱ.D的产量可以用来衡量一个国家的石油化工水平.
回答下列问题:
(1)D与C分子中官能团的名称分别为 , E的结构简式是 .
(2)D→E的反应类型为 .
(3)上述A、B、C、D、E、X六种物质中,互为同系物的是(填字母代号).
(4)反应C+E→X的化学方程式为 .
(5)反应A→B的化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1mol/L的二元酸H2A溶液中,溶液体系可能存在的含A粒子(H2A、HA﹣、A2﹣)所占物质的量分数随pH变化的关系如图所示,下列说法正确的是( )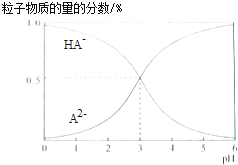
A.H2A的电离方程式为:H2AH++HA﹣
B.pH=5时,在NaHA和Na2A的混合溶液中:c(HA﹣):c(A2﹣)=1:100
C.等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为c(Na+)>c(HA﹣)>c(A2﹣)
D.Na2A溶液必存在c(OH﹣)=c(H+)+c(HA﹣)+2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组反应(表示物质均为反应物)中,反应刚开始时,放出氢气速率最大的是( )
编号 | 金属(块状) | 酸的浓度及体积 | 反应温度(℃) |
A | 0.2mol Mg | 10 mL2.5 mol·L-1硫酸 | 60 |
B | 0.2mol Mg | 40 mL3 mol·L-1盐酸 | 60 |
C | 0.2mol Fe | 50 mL5 mol·L-1盐酸 | 60 |
D | 0.2mol Mg | 20 mL2.5 mol·L-1硫酸 | 50 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是( ) 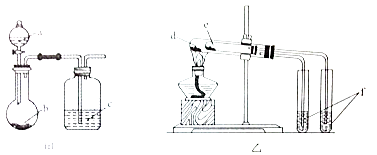
选项 | 实验试剂 | 实验结论 | ||
A | a.稀硫酸 | b.碳酸氢钠 | c.硅酸钠溶液 | 酸性:硫酸>碳酸>硅酸 |
B | a.稀盐酸 | b.二氧化锰 | c.溴化钠溶液 | 氧化性:MnO2>Cl2>Br2 |
C | d.小苏打 | e.苏打 | f.石灰水 | 热稳定性:苏打>小苏打 |
D | d.氯化钠 | e.氯化铵 | f.硝酸银溶液 | 沸点:氯化钠>氯化铵 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及部分重要化合物的相互转化如图所示.
①步骤Ⅰ为白磷的工业生产方法之一,反应在1300℃的高温炉中进行,其中SiO2的作用是用于造渣(CaSiO3),焦炭的作用是;
②不慎将白磷沾到皮肤上,可用0.2mol/L CuSO4溶液冲洗,根据步骤Ⅱ可判断,1mol/L CuSO4溶液所能氧化的白磷的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述正确的是( )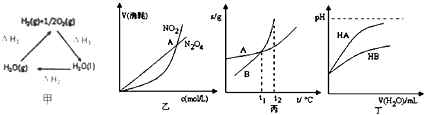
A.甲中△H1=﹣(△H2+△H3)
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A,B两物质的溶解度随温度变化情况,将tl℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA,HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于等物质的量浓度的NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示:已知气体分压(P分)=气体总压(P总)×体积分数,下列说法正确的是( ) 
A.550℃时,若充入惰性气体,v正 , v退均减小,平衡不移动
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种酸溶液,能跟锌片反应生成氢气且最初反应速率最快的是
A. 20℃ 20mL 2mol/L的硫酸溶液B. 20℃ 30mL 2mol/L的盐酸溶液
C. 10℃ 20mL 3mol/L的盐酸溶液D. 50℃ 10mL8mol/L的硝酸溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com