
常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )
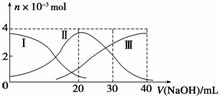
A.H2A在水中的电离方程式是:H2A===H++HA-、HA-H++A2-
B.当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
C.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
D.当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-)
答案 B
解析 A项,H2A的第1步电离也是部分电离;B项,当V(NaOH)=20 mL时,发生反应H2A+NaOH===NaHA+H2O,根据图像,此时的溶液呈酸性,所以c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);C项,当生成NaHA时,电离大于水解,仍抑制水的电离,故溶液中水的电离程度比纯水的小;D项,当V(NaOH)=30 mL时,NaHA和Na2A等量共存。2c(Na+)=3c(HA-)+3c(H2A)+3c(A2-)c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)。即2c(H+)+c(HA-)+3c(H2A)=2c(OH-)+c(A2-)。


科目:高中化学 来源: 题型:
如右图所示,在常况下容器 A 中盛有 500mL 蒸馏水,在容器 B 中盛有 500ml 1mol/L的盐酸,在烧瓶 C 和 D 中充满二氧化氮气体,并用导管将它们连通。向 A 容器中加入 50g 硝酸铵晶体,小心搅拌,使其迅速溶解;向B中加入 10g 苛性钠固体,小心搅拌也使其迅速溶解,随着A、B中固体物质的溶解,烧瓶 C 和 D 中气体的颜色变化是
A. 不变 B. 烧瓶 C 中颜色变深,D 中变浅
C. 烧瓶 D 中变深, C 中变浅 D. 两个烧瓶中的颜色都变深
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应mA(固)+nB(气) e C(气)+f D(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是
e C(气)+f D(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是
A.达平衡后,加入催化剂则C%增大
B.达平衡后,增加A的量有利于平衡向右移动
C.化学方程式中n>e+f
D.达平衡后,若升温,平衡左移
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是( )

| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | Cu | FeCl3溶液 | CuCl2溶液 | Fe |
| B | H2O | Fe | H2 | O2 |
| C | Al | NaOH溶液 | H2 | Al2O3 |
| D | CH3CH2OH | O2 | CH3CHO | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中微粒的物质的量浓度关系正确的是( )
A.氯水中:c(Cl2)=2c(ClO-)+2c(Cl-)+2c(HClO)
B.Na2CO3溶液:c(OH-)+c(H+)=c(HCO )+2c(H2CO3)
)+2c(H2CO3)
C.等浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO )+c(H2CO3)
)+c(H2CO3)
D.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:
c(Na+)>c(SO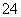 )>c(NH
)>c(NH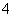 )>c(OH-)=c(H+)
)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.100 0 mol·L-1 HA溶液(滴定曲线见图1)和20.00 mL 0.100 0 mol·L-1 HB溶液(滴定曲线见图2)。下列说法正确的是( )
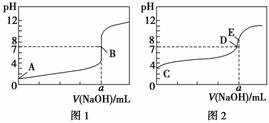
A.图1可以表示NaOH滴定盐酸的曲线
B.图1中B点状态时,溶液中有:c(Na+)=c(A-)
C.达到B、E状态时,反应消耗n(HA)<n(HB)
D.当0<V(NaOH)<20.0 mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
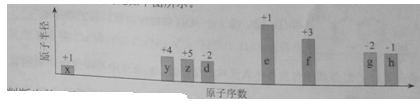
根据判断出的元素回答问题:
(1)f在元素周期表的位置是__________。
(2)比较d、e常见离子的半径的小(用化学式表示,下同)_______>__________;比较g、h的最高价氧化物对应的水化物的酸性强弱是:_______>__________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式__________。
(4)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式:___________________。
(5)上述元素可组成盐R:zx4f(gd4)2,向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:
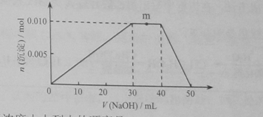
①R离子浓度由大到小的顺序是:__________。
②写出m点反应的而梨子方程式_________________。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
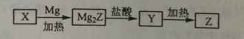
(1)能与X发生化学反应的酸是 ;由X制备Mg2Z的化学方程式为 。
(2)由Mg2Z生成Y的化学反应方程式为 ,Y分子的电子式为 。
(3)Z.X中共价键的类型分别是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 L 1 mol·L-1的NaClO溶液中含有ClO-的数目为NA
B.78 g苯含有C===C双键的数目为3NA
C.常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com