
【题目】(1)基态Fe2+的核外电子排布式为_______________,基态Ti3+的未成对电子有_____个。
(2)1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为________________
(3)有机物 HCHO的VSEPR构型为_______________。(填名称)
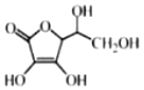
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的轨道杂化类型为_________、____________
(5)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,请根据实验现象写出有关反应的离子方程式______________; ________。
(6)已知:下列物质断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
共价键 | H﹣H | N﹣H | N≡N |
能量变化/kJmol﹣1 | 436 | 390.8 | 946 |
则合成氨反应:N2(g)+3H2 (g)=2NH3(g)△H=_________kJmol﹣1
【答案】[Ar]3d6 或 1s22s22p63s23p63d6 1 8NA 平面三角形 sp2 sp3 Cu2++2NH3H2O=Cu(OH)2↓+2NH4+; Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH﹣ -90.8
【解析】
(1)Fe为26号元素,核外电子排布式为1s22s22p63s23p63d64s2,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6或[Ar]3d6,Ti元素为22号元素,核外电子排布式为1s22s22p63s23p63d24s2,基态Ti3+的核外电子排布式为1s22s22p63s23p63d1未成对电子有1个。
答案为:[Ar]3d6 或 1s22s22p63s23p63d6 ;1 ;
(2)1个(CO)中含有1个σ键,4个(CO)中含有4个σ键,4个(CO)与Ni 结合形成4个σ键,故一个[Ni(CO)4]2+中含有8个σ键;1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为8NA ;
答案为:8NA;
(3)有机物 HCHO的中心原子是碳原子,其价电子对数为3,采用sp2杂化,共4个原子,VSEPR构型为平面三角形;
答案为:平面三角形;
(4)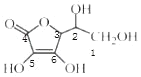 中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;
中1、2、3号C原子价层电子对个数是4,4、5、6号碳原子价层电子对个数是3,根据价层电子对互斥理论判断该分子中C原子轨道杂化类型,1、2、3号C原子采用sp3杂化,4、5、6号C原子采用sp2杂化;
故答案为:sp3、sp2;
(5)向硫酸铜中逐滴加入氨水先产生氢氧化铜沉淀,后沉淀溶解生成[Cu(NH3)4]2+,溶液呈深蓝色溶液,反应离子方程式为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
故答案为:Cu2++2NH3H2O=Cu(OH)2↓+2NH4+;Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-;
(6)由表中数据可知,N2(g)+3H2(g)=2NH3(g)△H=946kJ/mol+436kJ/mol×32×3×390.8kJ/mol=90.8kJ/mol,
故答案为:90.8。


科目:高中化学 来源: 题型:
【题目】镁及其合金是一种用途很广的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下:

(1)为了使MgSO4转化为Mg(OH)2,试剂①可以选用________,要使MgSO4完全转化为沉淀,加入试剂的量应为________________。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是_____________。
(3)试剂②选用________;写出其反应的离子方程式_______。
(4)无水MgCl2在熔融状态下,通电后产生镁和氯气,该反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案。请你帮助他们完成有关实验项目:
方案I:有人提出将大小相等的铁片和铜片,分别同时放入稀硫酸(或稀盐酸)中,观察产生气泡的快慢,据此确定它们的活动性。该原理的离子方程式为_________________。
方案II:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性。试在下面的方框内画出原电池的装置图_________,标出原电池的电极材料和电解质溶液,并写出负极电极反应式负极反应式: ________________。

方案III;结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案1、II不能雷同) ________________用离子方程式表示其反应原理:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知HCN有剧毒;HCN、HOCN中N元素的化合价相同。
a.碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1, Q与水反应的化学方程式为__________。
b.NaCN超标的电镀废水可用两段氧化法处理:
①.NaCN与NaClO反应,生成NaOCN和NaCl
②.NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
完成下列填空:
①写出第二次氧化时发生反应的离子方程式 __________________________
②(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________和H2O。
③处理200 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___ g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用如图装置来测定某原电池工作时在某段时间内通过导线的电子的物质的量。量筒的规格为1 000 mL,供选择的电极材料有纯铜片和纯锌片。
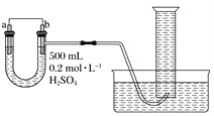
请回答下列问题:
(1)b电极材料为___,其电极反应式为____。
(2)当量筒中收集到672 mL(标准状况下)气体时,通过导线的电子的物质的量为___mol,此时a电极质量____(填“增加”或“减少”)___g。
(3)如果将a、b两电极的电极材料对调,U形管中将出现的现象是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。下列说法错误的是( )

A.在图示的转化中,Fe3+和CuS是中间产物
B.在图示的转化中,化合价不变的元素只有铜
C.图示转化的总反应是2H2S+O2![]() 2S+2H2O
2S+2H2O
D.当有1molH2S转化为硫单质时,需要消耗O2的物质的量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y和Z的原子序数依次增大。W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y2+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.X的氢化物只含有极性共价键
B.Y单质可通过电解Y的氯化物获得
C.W与氢形成的原子比为1︰1的化合物有多种
D.W与Z形成化合物WZ2中各原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值,下列叙述正确的是( )
为阿伏加德罗常数的值,下列叙述正确的是( )
A.某温度下,78 g ![]() 与适量的
与适量的![]() 恰好完全反应,转移的电子数为
恰好完全反应,转移的电子数为![]()
B.苯与液溴反应生成1 mol溴苯,消耗0.5![]() 个
个![]()
C.![]() 的
的![]() 溶液中,含有
溶液中,含有![]() 的数目为
的数目为![]()
D.100 g 46%的乙醇溶液中,含H—O键的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com