
| A. | a>b>c | B. | b>a>c | C. | c>b>a | D. | b>c>a |
分析 相同温度下,在体积相等的密闭容器,a为恒温恒容容器,b容器为恒压且可以和外界进行热交换的装置,c为恒容绝热容器,起始物质的量相同,该反应是气体体积减小的放热反应,c的温度大于a,b容器为恒压且可以和外界进行热交换的装置,b中压强大于a,根据压强、温度对平衡的影响判断•
解答 解:已知N2+3H2?NH3△H<0,反应是气体体积减小的放热反应,相同温度下,在体积相等的密闭容器,a为恒温恒容容器,b容器为恒压且可以和外界进行热交换的装置,c为恒容绝热容器,起始物质的量相同,该反应是气体体积减小的放热反应,c的温度大于a,反应物的转化率减小,a>c,b容器为恒压且可以和外界进行热交换的装置,b中压强大于a,反应物转化率b>a,反应物的转化率的关系b>a>c,故选B.
点评 本题考查了化学平衡影响因素,容器特征、化学平衡移动原理,注意恒温恒容容器、恒温恒压容器、恒容绝热容器改变条件对平衡的分析方法,题目难度中等.


科目:高中化学 来源: 题型:解答题
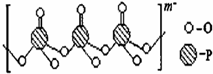 磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(
磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(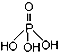 ),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:
),三聚磷酸钠(NaH2PO2)可用于化学镀镍等等.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
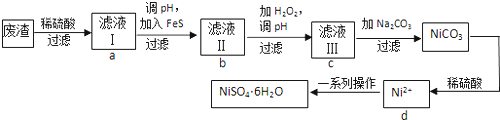
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.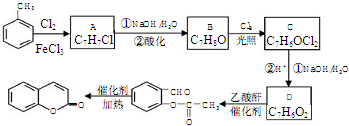
 ,A→B的反应类型是取代反应.
,A→B的反应类型是取代反应. )反应,除生成
)反应,除生成 外,同时生成的另一种产物的结构简式是CH3COOH.
外,同时生成的另一种产物的结构简式是CH3COOH. 互为同分异构体,且具有以下特点:
互为同分异构体,且具有以下特点:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属.请回答下列问题
A、B、C、D、E、F为前四周期原子序数依次增大的六种元素,A、C、D原子均有两个未成对电子,A、B、C同周期,A与D、B与F分别同主族,E是生活中用量最大的金属.请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;写出A分子中官能团的名称羟基、羧基;
;写出A分子中官能团的名称羟基、羧基; ;
;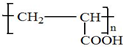 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都是高分子化合物 | |
| B. | 乙醇和乙酸都能与金属钠反应生成氢气 | |
| C. | 淀粉(C6H10O5)n和纤维素(C6H10O5)n互为同分异构体 | |
| D. | 石油的分馏和煤的干馏均只发生物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 向甲酸钠溶液中加新制的Cu(OH)2并加热 | 确定甲酸钠具有醛基性质 |
| B | 加溴水,振荡,过滤除去沉淀 | 除去苯中混有的苯酚 |
| C | 给碳酸钠溶液中加入浓盐酸,将产生的气体通入苯酚钠溶液 | 验证酸性: 盐酸>碳酸>苯酚 |
| D | 氯乙烷和氢氧化钠的乙醇溶液共热,将产生的气体通入酸性高锰酸钾溶液 | 验证产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com