

| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+2H2O-4e-═4OH-,溶液pH升高 |
| C、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
| D、烧杯b中发生的电极反应为Zn-2e-═Zn2+ |


科目:高中化学 来源: 题型:
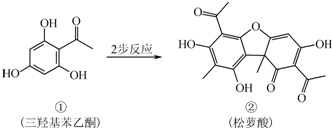
| A、有机物①的分子式为C8H8O4 |
| B、有机物②中含有1个手性碳原子 |
| C、检验②中是否含有杂质①,可用FeCl3溶液 |
| D、相同物质的量①、②与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
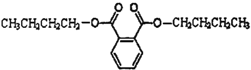 邻苯二甲酸二丁酯是一种常用的塑化剂,其结构简式如图所示.下列关于塑化剂的说法正确的是( )
邻苯二甲酸二丁酯是一种常用的塑化剂,其结构简式如图所示.下列关于塑化剂的说法正确的是( )| A、能溶于水 |
| B、与乙二酸二乙酯互为同系物 |
| C、可用邻苯二甲酸和丁醇酯化制得 |
| D、完全燃烧1mol该有机物需要436.8L O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、若X为NaCl,K与M相连时,石墨电极反应为2Cl--2e-═Cl2↑ |
| B、若X为硫酸,K与M相连时,Fe作负极受到保护 |
| C、若X为硫酸,K与N相连时,溶液中H+向Fe电极移动 |
| D、若X为NaCl,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )
25℃时,向20.00mL NaOH溶液中逐滴加入0.20mo1?L-1的CH3COOH溶液得到如图曲线.下列说法正确的是( )| A、水电离出的氢离子浓度:a>b |
| B、c点时恰好中和 |
| C、在d~e之间存在如下关系C(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、e点时溶液中溶质是CH3COONa和CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、1mol该有机物最多可以和5mol NaOH反应 |
| B、1mol该有机物与浓溴水反应,最多消耗3mol Br2 |
| C、该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色 |
| D、该有机物容易发生加成、取代、中和、消去等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、DCHP的分子式为C20H28O4 |
| B、上述制备DCHP的反应属于取代反应 |
| C、DCHP苯环上的一氯代物有4种 |
| D、1mol DCHP最多可与含4mol NaOH的溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
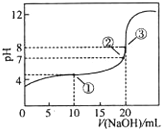 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol?L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,正确的是( )| A、该中和滴定过程,最宜用石蕊作指示剂 |
| B、图中点②所示溶液中,c(CH3COO-)=c(Na+) |
| C、图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 |
| D、滴定过程中的某点,会有c(Na+)>c(CH3COO-)>c(H+)>c(OH-)的关系存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com