
| A、2H2(g)+O2(g)=2H2O (l)△H=-285.8 kJ?mol-1 |
| B、2H2(g)+O2(g)=2H2O (l)△H=+571.6 kJ?mol-1 |
| C、2H2(g)+O2(g)=2H2O (g)△H=-571.6 kJ?mol-1 |
| D、H2(g)+1/2O2(g)=H2O (l)△H=-285.8 kJ?mol-1 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、反应(1)和(2)均为氧化还原反应 |
| B、反应(1)的氧化剂是O2,还原剂是FeO?Cr2O3 |
| C、高温下,O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D、反应(1)中每生成1molNa2CrO4时电子转移3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、测得0.1 mol?L-1氨水的pH为11:NH3?H2O?NH4++OH- | ||||
| B、将Na块投入水中,产生气体:2Na+2H2O═2NaOH+H2↑ | ||||
C、用CuCl2溶液做导电实验,灯泡发光:CuCl2
| ||||
D、将1 mol?L-1FeCl3溶液滴入沸水中,得到透明红褐色液体:FeCl3+3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuCl2(CuO) |
| B、NaOH(Na2O) |
| C、NaCl(NaCl) |
| D、H2SO4(H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,2.24 L HF含有的电子数为NA |
| B、7.8 g Na2S和Na2O2的混合物中所含离子数为0.3NA |
| C、常温下,2.7 g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA |
| D、电解精炼铜时,阳极质量每减少32 g,电路中就转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
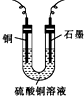 当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示:
当pH为4~5时,Cu2+几乎不水解,而Fe3+几乎完全沉淀.某同学欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量.实验过程中使用肼(N2H4)-空气燃料电池作直流电源,其实验过程如图所示: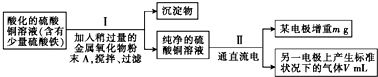
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=
某温度下,将三种气体充入一密闭容器中,所发生反应的平衡常数可表示为K=| c(CH3OCH3)?c(H2O) |
| c2(CH3OH) |
| 表一 | ||
| T/℃ | 400 | 500 |
| K | 32 | 44 |
| 表二 | |||
| 物质 | CH3OH | CH3OCH3 | H2O |
| 物质的量浓度(mol?L-1) | 0.54 | 0.68 | 0.68 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| B、电解法精炼粗铜,用纯铜作阴极 |
| C、电解熔融的氧化铝制取金属铝,用镁作阳极 |
| D、在镀件上电镀锌,用锌作阳极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com