
| 1min | 2min | 5min | 15min | 20min | |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 打量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol•L-1H2SO4 | 均无明显现象(只有少量气泡) | ||||
分析 (1)在金属活动顺序表中,铝排在氢的前面,铝与非强氧化性酸中的氢离子反应生成铝离子和氢气;
(2)根据该反应的反应热及溶液中氢离子的浓度判断,温度越高反应速率越快,金属和酸的反应是放热反应,反应物浓度越小,反应速率越小;
(3)利用固定变量法探究氯离子和硫酸根离子对金属铝与H+反应的影响.
解答 解:(1)盐酸、稀硫酸为非强氧化性的酸,铝与酸反应生成铝离子和氢气,离子方程式为:2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑;
(2)反应1~15min内,铝与酸的反应是放出热量的,导致温度升高,使化学反应速率加快,随着反应的进行,15~20min内,溶液中氢离子的浓度逐渐减小,浓度越小,反应速率越小.
故答案为:反应1~15min内,反应放出热量,温度升高,使化学反应速率加快;15~20min内,由于溶液中H+浓度降低,所以导致反应速率减小;
(3)H+浓度相同的稀盐酸、稀硫酸反应,只有酸根离子不同,考虑酸根离子对反应速率的影响设计实验方案.假设二:SO42对金属铝与H+反应没有影响,假设三:SO42对金属铝与H+反应有抑制作用,假设四:也可从带低电荷的阴离子对金属铝与H+反应有促进作用角度考虑,
氯离子对铝与酸的反应有促进作用,在铝与硫酸反应的溶液中加入氯化钠固体,观察反应速率是否加快,若速率加快,说明Cl-对该反应有促进作用;若速率不变,说明Cl-对该反应的速率不影响,
硫酸根离子对铝与酸的反应有抑制作用.为了验证该假设,在铝与硫酸反应的溶液中加入硫酸钾固体,观察反应速率,看反应速率有无变化及变化情况,来判断SO42-是否对反应起作用,
故答案为:SO42对金属铝与H+反应没有影响;SO42对金属铝与H+反应有抑制作用;带低电荷的阴离子对金属铝与H+反应有促进作用;将NaCl颗粒加入Al片与稀盐酸反应液中,看反应速率有无变化及变化情况,来判断Cl-是否对反应起作用.若速率加快,说明Cl-对该反应有促进作用;若速率不变,说明Cl-对该反应的速率不影响.将K2SO4颗粒加入Al片与稀H2SO4反应液中,看反应速率有无变化及变化情况,来判断SO42-是否对反应起作用.若速率减小,说明SO42对该反应有抑制作用;若速率不变,说明SO42对该反应的速率不影响.
点评 本题是一道实验探究题,考查了催化剂对化学反应速率的影响,解题的方法是:利用固定变量法设计实验论证假设,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 含杂质的物质 | 试剂 | 除杂方法 |
| A | CH4(C2H4) | Br2水 | 洗气 |
| B | C6H6(Br2) | Fe粉 | 蒸馏 |
| C | C6H5NO2(HNO3) | NaOH溶液 | 分液 |
| D | C2H2(H2S) | CuSO4溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
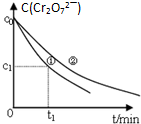 某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸H2C2O4能将其中的Cr2O72-转化为Cr3+.某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:| 实验编号 | 初始c(H+) | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
| ① | 1.0×10-4 | 60 | 10 | 30 |
| ② | 1.0×10-5 | 60 | 10 | 30 |
| ③ | 1.0×10-5 | 60 |
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 用等物质的量的K2SO4•Al2(SO4)3•24H2O代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比试验. | 反应进行相同时间后,若溶液中的Cr2O72-浓度大于实验①中Cr2O72-浓度,则假设一成立;若两溶液中的Cr2O72-浓度相同,则假设一不成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
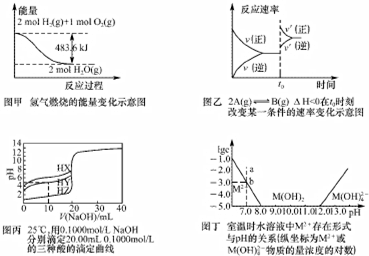
| A. | 由图甲可知:H2的燃烧热为241.8kJ/mol | |
| B. | 由图乙可知:t0时刻改变的条件是增大压强或者升高温度 | |
| C. | 由图丙可知:将上述HX、HY、HZ溶液等体积混合,用NaOH溶液滴定至HX恰好完全反应时,溶液中的离子浓度:c(Z-)>c(X-)>c(Y-)>c(OH-)>c(H+) | |
| D. | 由图丁可知:室温时M(OH)2(s)的溶度积常数为1.0×10-17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com