
| A. | △H3=△H1+2△H2 x=xy2 | B. | H3=△H1+△H2 z=x+y | ||
| C. | H3=△H1+2△H2 x=x-y2 | D. | H3=△H1+△H2 z=$\frac{x}{y}$ |
分析 根据三个化学反应方程式可知,反应2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)可由另两个反应加和得到,则由盖斯定律可知,△H3应为另两个反应反应热的加和,以此计算平衡常数关系.
解答 解:①2H2O(g)=2H2(g)+O2(g)△H1;
②H2(g)+Cl2(g)=2HCl(g)△H2 ;
③2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3;
则反应③=①+2×②,
由盖斯定律可知,
△H3=△H1+2△H2,
且x=xy2,
故选A.
点评 本题考查学生利用盖斯定律来计算反应热的关系以及平衡常数的计算,为高频考点,明确化学反应的关系,在加和反应时等号同侧的相加,当乘以一个系数时反应热也要乘以这个系数来解答即可.


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 亚硫酸盐作为食品添加剂,作用是防腐保鲜 | |
| B. | 反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出 | |
| C. | 测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量 | |
| D. | 若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应④的反应类型是加聚 | B. | 物质A含有两种官能团 | ||
| C. | 物质B催化氧化后可以得到乙醛 | D. | 1mol物质D最多可以消耗2molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.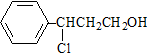 $→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$$→_{Ⅱ}^{一定条件}$乙 ,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.
,设计步骤Ⅰ的目的是保护碳碳双键,防止被氧化.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
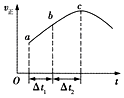 向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )
向绝热恒容密闭容器中通入CO和H2O(g),在一定条件下使反应CO(g)+H2O(g)?CO2(g)+H2(g)达到判平衡,正反应速率随时间变化的示意图如图所示.由图可得出的正确结论是( )| A. | 反应物的总能量低于生成物的总能量 | |
| B. | △t1=△t2时,CO的转化率:a~b段小于b〜c段 | |
| C. | 反应在c点达到平衡状态 | |
| D. | 反应物浓度:a点小于b点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 | |
| C. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| D. | 在“中和热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| C-H | C-O | C=O | H-H | H-O |
| 413.4 | 351 | 745 | 436 | 462.8 |
| 实验 | 温度/℃ | 起始量] | 达到平衡 | |||
| CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
| 1 | 650 | 4 | 2 | 1.6 | 6 | |
| 2 | 900 | 2 | 1 | 25% | 3 | |
| 3 | 900 | a | b | c | t | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com