
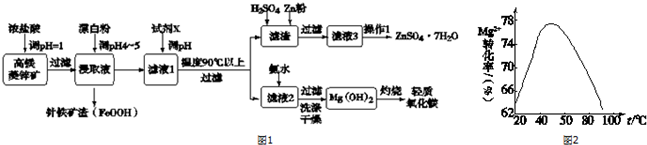
| Zn2+ | Mg2+ | Cu2+ | Fe3+ | Fe2+ | |
| 开始沉淀pH | 5.9 | 9.4 | 4.7 | 2.7 | 7.6 |
| 完全沉淀pH | 8.2 | 12.4 | 6.7 | 3.7 | 9.6 |
分析 高镁菱锌矿(主要含ZnCO3、MgCO3、CaCO3以及少量SiO2、Fe2O3、Cu等)加入浓盐酸调节溶液PH=1,Fe2O3、ZnCO3、MgCO3、CaCO3溶解,少量SiO2不溶解,铜和氯化铁溶液反应生成氯化亚铁,过滤得到浸取液中主要是FeCl3、FeCl2、ZnCl2、MgCl2、CuCl2、CaCl2,加入漂白粉调节溶液PH=4-5,除去铁离子和亚铁离子,过滤得到滤渣FeOOH,得到滤液1中加入试剂X可以选择氨水,pH的范围在8.2~9.4之间使锌、铜离子沉淀完全,控制温度在90℃以上的目的是为了促进Zn2+的水解,过滤得到滤渣主要是氢氧化锌和氢氧化铜,加入硫酸溶解后加入锌粉可以置换出铜,过滤除去铜得到滤液3为硫酸锌溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥等操作得到硫酸锌晶体,滤液2主要是镁离子,加入氨水过滤洗涤干燥得到氢氧化镁沉淀灼烧得到轻质氧化镁,
(1)浸取过程中产生Fe2+的反应为氧化铁溶于盐酸生成氯化铁溶液,氯化铁溶液和铜反应生成氯化亚铁和氯化铜;
(2)a.矿石粉碎能增大接触面积加快溶解速率;
b.试剂X可以选择氨水,pH的范围在8.2~9.4之间,使锌、铜离子沉淀完全;
c.加热促进Zn2+的水解;
d.滤渣中加入硫酸后再加入锌粉发生反应置换出铜,除去铜离子;
(3)由Fe2+生成针铁矿渣的反应是加入的漂白粉中的次氯酸根离子氧化亚铁离子生成,结合电荷守恒和原子守恒配平书写离子方程式;
(4)从滤液获取溶质的方法是依据物质溶解度随温度升高增大的特征,用蒸发浓缩、冷却结晶、过滤洗涤、干燥得到;
(5)①根据图中所示50℃前温度与Mg2+转化率之间 的关系是随温度升高镁离子转化率增大,反应是吸热反应;
②温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降.
解答 解:高镁菱锌矿(主要含ZnCO3、MgCO3、CaCO3以及少量SiO2、Fe2O3、Cu等)加入浓盐酸调节溶液PH=1,Fe2O3、ZnCO3、MgCO3、CaCO3溶解,少量SiO2不溶解,铜和氯化铁溶液反应生成氯化亚铁,过滤得到浸取液中主要是FeCl3、FeCl2、ZnCl2、MgCl2、CuCl2、CaCl2,加入漂白粉调节溶液PH=4-5,除去铁离子和亚铁离子,过滤得到滤渣FeOOH,得到滤液1中加入试剂X可以选择氨水,pH的范围在8.2~9.4之间使锌、铜离子沉淀完全,控制温度在90℃以上的目的是为了促进Zn2+的水解,过滤得到滤渣主要是氢氧化锌和氢氧化铜,加入硫酸溶解后加入锌粉可以置换出铜,过滤除去铜得到滤液3为硫酸锌溶液,通过蒸发浓缩、冷却结晶、过滤洗涤、干燥等操作得到硫酸锌晶体,滤液2主要是镁离子,加入氨水过滤洗涤干燥得到氢氧化镁沉淀灼烧得到轻质氧化镁,
(1)浸取过程中产生Fe2+的反应为氧化铁溶于盐酸生成氯化铁溶液,氯化铁溶液和铜反应生成氯化亚铁和氯化铜,反应的离子方程式为:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+,
故答案为:Fe2O3+6H+=2Fe3++3H2O、2Fe3++Cu=2Fe2++Cu2+;
(2)a.用浓盐酸浸取前,将矿石粉碎增大接触面积,能够提高浸出速率,故a正确;
b.试剂X可以选择氨水,图表数据分析可知,pH的范围在8.2~9.4之间,可以使锌、铜离子沉淀完全,锌离子不沉淀,故b错误;
c.控制温度在90℃以上的目的是为了促进Zn2+的水解,生成氢氧化锌,故c正确;
d.滤渣中加入硫酸后再加入锌粉是为了除去Cu2+,发生反应Zn+Cu2+=Cu+Zn2+,过滤除去,故d正确;
故答案为:acd;
(3)由Fe2+生成针铁矿渣的反应是加入的漂白粉中的次氯酸根离子氧化亚铁离子生成,结合电荷守恒和原子守恒配平书写离子方程式为:2Fe2++ClO-+3H2O=2FeOOH+Cl-+4H+,
故答案为:2Fe2++ClO-+3H2O=2FeOOH+Cl-+4H+;
(4)加热浓缩、冷却结晶;(5)①根据图中所示50℃前温度与Mg2+转化率之间 的关系是随温度升高镁离子转化率增大,反应是吸热反应;故答案为:吸热;
②图中,温度升高至50℃以上Mg2+转化率下降的可能原因是温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降,
故答案为:温度过高时,氨水受热分解,浓度降低,Mg2+转化率下降;
③用石灰乳代替氨水来制备氢氧化镁是因为:石灰乳中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),Mg2+可以与OH-反应生成更难溶的Mg(OH)2,使得OH-浓度不断下降,平衡右移,最终从Ca(OH)2转化为Mg(OH)2,
故答案为:石灰乳中存在Ca(OH)2(s)?Ca2+(aq)+2OH-(aq),Mg2+可以与OH-反应生成更难溶的Mg(OH)2,使得OH-浓度不断下降,平衡右移,最终从Ca(OH)2转化为Mg(OH)2.
点评 本题考查了物质的分离提纯方法,离子选择和离子除杂的实验过程分析判断,主要是实验设计和实验操作的熟练掌握,题目难度中等.


科目:高中化学 来源: 题型:解答题
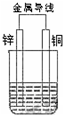 如图所示原电池
如图所示原电池查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素都属天然高分子化合物 | |
| B. | 食品包装袋中可用碱石灰做干燥剂 | |
| C. | 煤经过液化等物理变化可转化为清洁燃料 | |
| D. | 制作航天服的聚醋纤维属新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2固体中阴、阳离子个数比为1:1 | |
| B. | 由酸性HCl>H2CO3,可推知非金属性Cl>C | |
| C. | pH均为5的CH3COOH溶液和NH4Cl溶液中水的电离程度相同 | |
| D. | 常温下,浓度均为0.1mol/L的HA酸溶液与NaOH溶液等体积混合后(pH约为8),溶液中离子浓度关系:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温,NaHCO3溶解度比Na2CO3小,向饱和Na2CO3溶液中通入CO2产生沉淀 | |
| B. | 常温,SiO2与氢氟酸、NaOH溶液均可反应,SiO2是两性氧化物 | |
| C. | BaSO3难溶于水,SO2气体通入Ba(NO3)2溶液中产生沉淀 | |
| D. | 非金属性:Cl>S,酸性:HClO>H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中所有碳原子可能共平面 | |
| B. | 既能发生酯化反应又能发生氧化反应 | |
| C. | 1 mol该物质与H2完全加成,需消耗3 mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL1mol/LNa2CO3溶液中含有0.1NA个CO32- | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| C. | 1molCl2与过量Fe反应,转移的电子数为2 NA | |
| D. | 标准状况下,11.2L乙醇完全燃烧产生二氧化碳分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH=CH2 烯烃 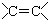 | B. | 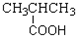 羧酸-COOH 羧酸-COOH | ||
| C. | 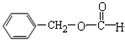 醛类 醛类 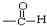 | D. | RCH2OH (R为烃基) 醇类-OH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com