
| A. | 每个${\;}_{55}^{137}Cs$原子中有82个中子 | |
| B. | CsOH的碱性比KOH强 | |
| C. | KIO3是碘的最高价氧化物的水化物的盐 | |
| D. | HI比HF还原性强 |
分析 A.原子中质量数=中子数+质子数,元素符号左上角为质量数,左下角为质子数;
B.同主族从上到下金属性增强,形成碱的碱性增强;
C.碘元素的最高价为+7价;
D.同主族非金属性减弱形成氢化物的还原性增强.
解答 解:A.原子中质量数=中子数+质子数,元素符号左上角为质量数,左下角为质子数,每个${\;}_{55}^{137}Cs$原子中有中子=137-55=82,故A正确;
B.同主族从上到下金属性增强,形成碱的碱性增强,CsOH的碱性比KOH强,故B正确;
C.碘元素的最高价为+7价,KIO3中碘元素化合价+5价,不是最高价,故C错误;
D.同主族非金属性减弱形成氢化物的还原性增强,HI比HF还原性强,故D正确;
故选C.
点评 本题考查了原子结构,同主族递变规律,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K+ H+ Fe2+ NO3- | B. | H+ Al3+ SO42- Cl- | ||
| C. | Na+ Al3+ HCO3- Cl- | D. | Na+ NH4+ OH- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两块铁片上均有铜析出 | B. | 两块铁片上均无铜析出 | ||
| C. | 浸过浓H2SO4 的铁片上有铜析出 | D. | 浸过浓H2SO4 的铁片上无铜析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 主要学习实验方法,体验一下实验操作即可,不必追求精确 | |
| B. | 应该先做好实验报告,并事先填好,再做实验 | |
| C. | 要实事求是地记录自己的测定结果 | |
| D. | 本组实验失误,实验报告可以参照邻组的结果 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHSO4和Ba(OH)2 | B. | AlCl3和NaOH | C. | Ba(HCO3)2和Ba(OH)2 | D. | NaAlO2和H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化合物仅含碳、氢两种元素 | B. | 该化合物中碳氢原子个数比为1:2 | ||
| C. | 该化合约中一定含有氧元素 | D. | 若要确定其分子式一定需要质谱仪 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有的酸和碱都能使指示剂变色 | |
| B. | 物质发生缓慢氧化时一定放出热量 | |
| C. | 检测某溶液的pH时,pH试纸要预先用水湿润 | |
| D. | 一氧化碳还原氧化铜后试管壁上留下的红色物质,用稀硫酸浸泡除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
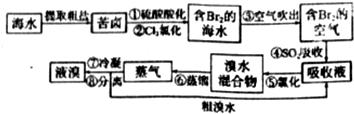
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com