
| A. | 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大 | |
| B. | 根据主族元素最高正化合价与族序数的关系,推出卤族元素最高正价都是+7 | |
| C. | 根据同周期元素的电负性变化趋势,推出Ar的电负性比Cl大 | |
| D. | 根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
分析 A.Mg的3s全满,为稳定结构;
B.F没有正价;
C.Ar为稀有气体,性质稳定;
D.CO2通入NaClO溶液中,发生强酸制取弱酸的反应.
解答 解:A.同周期元素的第一电离能从左向右增大,而Mg的3s全满,为稳定结构,则Al的第一电离能比Mg小,故A错误;
B.主族元素最高正化合价与族序数的关系,而卤族元素中除F外最高正价都是+7,故B错误;
C.同周期元素的电负性从左向右增大,而Ar的电负性比Cl小,Cl易得到电子,可知同周期中卤素原子的电负性最大,故C错误;
D.CO2通入NaClO溶液中,发生强酸制取弱酸的反应,规律合理,故D正确;
故选D.
点评 本题考查较综合,涉及元素周期律、物质结构与性质,为高频考点,把握电负性、电离能的比较方法及元素的性质、酸性比较为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名师点拨卷系列答案
名师点拨卷系列答案科目:高中化学 来源: 题型:解答题

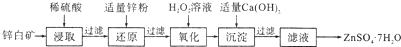
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 乙烯酮在一定条件下能与含活泼氢的化合物发生加成:它与下列试剂发生加成反应时所生成的产物不正确的是( )
乙烯酮在一定条件下能与含活泼氢的化合物发生加成:它与下列试剂发生加成反应时所生成的产物不正确的是( )| A. | 与HCl加成生成CH3COCl | B. | 与H2O加成生成CH3COOH | ||
| C. | 与CH3OH加成生成CH3COCH2OH | D. | 与CH3COOH加成生成(CH3CO)2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萃取时,要求萃取剂的密度比水的密度大 | |
| B. | 蒸馏时,温度计水银球与蒸馏烧瓶支管口相平 | |
| C. | 过滤时,要将待过滤混合物转移到漏斗中 | |
| D. | 分液时,分液漏斗的下口必须紧贴在烧杯壁上 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| B. | 元素周期表共有16个族,也就是16个纵行 | |
| C. | 同周期元素的电子层数相同 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Sr能与水反应,生成氢气 | |
| B. | Sr(OH)2具有两性 | |
| C. | SrSO4在水中溶解度很小 | |
| D. | SrCl2溶液和Na2CO3溶液能发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是金属元素 | |
| B. | 一定是ⅡA族元素 | |
| C. | 一定是非金属元素 | |
| D. | 可能是金属元素也可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
Ⅰ.控制变量法是化学实验的一种常用方法.下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| 1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
| 2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
| 3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
| 4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
| 5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
| 6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
| 7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料电池工作时O2在正极上发生氧化反应 | |
| B. | 燃料电池在工作时需要点燃甲烷 | |
| C. | 燃料电池工作时燃料在负极上发生氧化反应 | |
| D. | 燃料电池工作时负极的电极反应式为:2H2O+O2+4e-=4OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com