
| A、钠跟水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、硫酸铜溶液与氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ |
| C、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、NaOH溶液中通入少量SO2:2OH-+SO2═SO32-+H2O |


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:
 下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
| 序号 | 已知情境 | 化学式 | 对应的离子反应方程式和现象 |
| (1) | 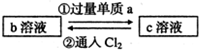 已知b溶液中滴入KSCN溶液后,溶液呈红色. |
a |
反应①的离子方程式 反应②的离子方程式 |
| (2) |  已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. 已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. |
c |
反应③的现象为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氯化钴溶液中加入一定量的浓盐酸,溶液颜色的变化是由粉红色变为蓝色 |
| B、已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量的CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4的溶解度比在水中的大 |
| C、在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸中,待产生氢气的速率速率突然减小,可以判断锌镀层已反应完全 |
| D、标定NaOH溶液的基准物质可用草酸、苯甲酸、邻苯二甲酸氢钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1L 1mol/L的AlCl3溶液中Al3+数是0.1NA |
| B、标准状况下,2.24L甲烷分子的电子数是NA |
| C、25℃时,pH=13的1.0L的Ba(OH)2溶液中含有的OH-数是0.2 NA |
| D、0.1L 1mol/L的醋酸溶液中的分子数是0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 2 |
| 3 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
(1)依据第2周期元素第一电离能的变化规律,参照右图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置.
| ||

 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸盐和盐酸反应生成CO2和水 |
| B、碳酸盐和强酸反应生成CO2和水 |
| C、可溶性碳酸盐和强酸反应生成CO2和水 |
| D、可溶性酸式碳酸盐和强酸反应生成CO2和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.尿素是一种氮肥,溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是
Ⅰ.尿素是一种氮肥,溶于水缓慢水解产生碳酸铵,碳酸铵溶液显碱性,原因是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com