
| A. | 用乙醇萃取溴水中的溴单质 | |
| B. | 用干燥的pH试纸测定新制氯水的pH | |
| C. | 向NH4Cl溶液中滴加石蕊试液,溶液变红,证明NH4Cl发生了水解反应 | |
| D. | 向蒸馏水中滴加过量的饱和FeCl3溶液,并不断搅拌,制取Fe(OH)3胶体 |
分析 A.乙醇与水互溶;
B.氯水中含HClO,具有漂白性;
C.NH4Cl溶液水解显酸性,石蕊遇酸变红;
D.滴加过量的饱和FeCl3溶液,胶体可发生聚沉.
解答 解:A.乙醇与水互溶,乙醇不能作萃取剂,应选苯或四氯化碳,故A错误;
B.氯水中含HClO,具有漂白性,应选pH计,故B错误;
C.NH4Cl溶液水解显酸性,石蕊遇酸变红,则滴加石蕊试液,溶液变红,证明NH4Cl发生了水解反应,故C正确;
D.滴加过量的饱和FeCl3溶液,胶体可发生聚沉,不能加过量,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握混合物分离提纯、物质的性质、盐类水解、胶体制备、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 反应一段时间后,X与Y的物质的量之比仍为1:1 | |
| B. | 达到平衡时,且反应放出0.1aKJ的热量 | |
| C. | 达到平衡后,若向平衡体系中充入稀有气体,Z的正反应速率将不发生变化 | |
| D. | X的体积分数保持不变,说明反应已达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol/L的盐酸溶液中,所含HCl分子数为NA | |
| B. | 常温常压下,71gCl2溶于水,转移的电子数目为0.1NA | |
| C. | 标准状况下,22.4LSO2和SO3的混合物,含硫原子的数目为NA | |
| D. | 0.5mol乙醇中含有的极性共价键数目为3.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
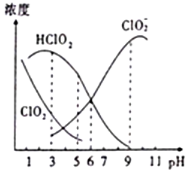 织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体.25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出).下列说法不正确的是( )
织物漂白剂亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都只有漂白作用,但ClO2是有毒气体.25℃时,各组分浓度随pH变化情况如图所示(Cl-没有画出).下列说法不正确的是( )| A. | 25℃时,ClO2-的水解平衡常数Ka=10-6 | |
| B. | 在pH约为4.0~4.5范围内使用该漂白剂较好 | |
| C. | 25℃时,等浓度的HClO2溶液和NaClO2溶液等体积混合后,混合溶液中:c(HClO2)+c(H+)+c(Na+)═c(ClO2-)+2c(OH-) | |
| D. | 当pH=5时往NaClO2溶液中滴入稀氢氧化钠溶液,溶液中主要反应的离子方程式是:HClO2+OH-═H2O+ClO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 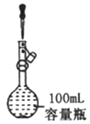 定容 | |
| B. | 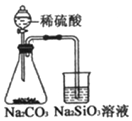 比较硫、碳、硅三种元素的非金属性强弱 | |
| C. | 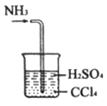 处理尾气 | |
| D. | 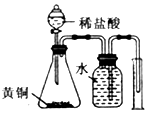 测定黄铜(Cu、Zn合金)中Zn的含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 应用 | 解释 |
| A | 在相同条件下,在两支试管中各加入2mL 5% H2O2溶液,再向H2O2溶液中分别滴入1mL H2O和1mL 0.1mol•L-1 FeCl3溶液,对比观察现象 | 可以探究催化剂FeCl3对H2O2 分解速率的影响 |
| B | 向盛有1mL 0.01mol•L-1 AgNO3溶液的试管中滴加5滴0.01mol•L-1 NaCl溶液,有白色沉淀生成,再向其中滴加0.01mol•L-1 KI溶液,产生黄色沉淀. | 常温下,Ksp(AgCl)>Ksp(AgI) |
| C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出 | 蛋白质均发生变性 |
| D | 保存硫酸亚铁溶液需加入少量稀盐酸和铁钉 | 防止 Fe2+水解以及被 O2 氧化 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaOH | B. | NH3•H2O | C. | CuO | D. | Cu(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
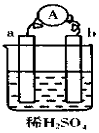
| A. | 碳棒上有气体放出,溶液pH变大 | |
| B. | a是正极,b是负极 | |
| C. | 导线中有电子流动,外电路中,电流从b极到a极 | |
| D. | a极上发生了氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com