
| A. | 氰化钾中含有离子键和极性键 | |
| B. | 氰化钾中碳元素的化合价为+4价 | |
| C. | KCN与KMnO4溶液反应可能生成CO2和N2 | |
| D. | 相同条件下,KCN溶液的碱性强于CH3COOK溶液 |
分析 A、氰化钾中钾离子与CN-之间形成离子键,而CN-中碳与氮之间形成极性共价键;
B、根据化合价代数和为0;
C、KMnO4溶液具有强氧化性;
D、露置空气中吸收H2O和CO2产生HCN,则碳酸的酸性强于氰化氢的酸性,而醋酸的酸性强于碳酸的酸性,所以醋酸的酸性强于氰化氢的酸性,酸根对应的酸越弱,水解程度越大,碱性越强.
解答 解:A、氰化钾中钾离子与CN-之间形成离子键,而CN-中碳与氮之间形成极性共价键,所以氰化钾中含有离子键和极性键,故A正确;
B、根据化合价代数和为0,氰化钾中碳元素的化合价为+2价,故B错误;
C、KMnO4溶液具有强氧化性,能将CN-氧化成CO2和N2,故C正确;
D、露置空气中吸收H2O和CO2产生HCN,则碳酸的酸性强于氰化氢的酸性,而醋酸的酸性强于碳酸的酸性,所以醋酸的酸性强于氰化氢的酸性,酸根对应的酸越弱,水解程度越大,碱性越强,所以KCN溶液的碱性强于CH3COOK溶液,故D正确;
故选B.
点评 本题考查氧化还原反应、元素化合物的性质,把握题干信息及知识迁移应用为解答的关键,侧重分析的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 4 | 10 | 1 | 25 |
| 反应后的质量/g | 未测定 | 21 | 10 | 9 |
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 装置 | ① | ② | 实验现象 | 结论 | |
 | A | 铜丝 | 稀硝酸 | ②中出现红棕色气体 | 稀硝酸与铜生成了NO2 ③中需要碱溶液吸收尾气 |
| B | 铜丝 | Fe2(SO4)3溶液 | ②中溶液黄色变浅 | Cu与Fe2(SO4)3溶液 发生置换反应 | |
| C | 铁丝 | 饱和 食盐水 | ③中导管内液面上升 | 铁钉发生吸氧腐蚀 | |
| D | 铁丝 | 浓硫酸 | 无明显现象 | 铁与浓硫酸不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应表明拆开N-C键比N-N键容易 | B. | 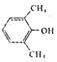 属于芳香醇的异构体有5种 属于芳香醇的异构体有5种 | ||
| C. | PHAC是一种酸式盐 | D. | PHAC能用于制造高能炸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cr2O72-中Cr元素化合价为+6 | |
| B. | 氧化产物为CH3COOH | |
| C. | K2Cr2O7溶液常用硫酸酸化 | |
| D. | lmol C2H5OH发生上述反应转移2mole- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  | 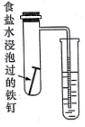 | 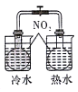 |
| 完成化学能转化为电能 | 证明非金属性强弱 S>C>Si | 验证铁发生析氢腐蚀 | 验证温度对平衡移动的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制氢弹用到的D、T互为同位素 | |
| B. | 苛性钠溶液可用于治疗胃酸过多 | |
| C. | 硅胶可防止月饼等食品氧化变质 | |
| D. | 向海水中加入净水剂明矾可以使海水淡化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| C. | 0.10mol/L小苏打溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | 等体积,pH=3的盐酸和醋酸分别与足量锌反应后,c(Cl-)=c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com