
| A.呈酸性 | B.c(H+)=1×10-6mol/L |
| C.c(OH-)=1×10-6mol/L | D.无法判断 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:不详 题型:填空题
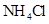 ②0.1mol/L
②0.1mol/L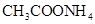 ③0.1mol/L
③0.1mol/L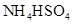
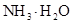 和0.1mol/L
和0.1mol/L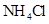 混合液 ⑤0.1mol/L
混合液 ⑤0.1mol/L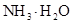
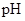 最小的是 ;
最小的是 ; 最小的是 (填序号)
最小的是 (填序号)  的大小关系是② ③(填“>”、“<”或“=”)。
的大小关系是② ③(填“>”、“<”或“=”)。 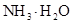 和 离子的物质的量浓度之和为0.2mol/L。
和 离子的物质的量浓度之和为0.2mol/L。 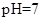 ,则说明
,则说明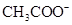 的水解程度 (填“>”、“<”或“="”" )
的水解程度 (填“>”、“<”或“="”" )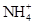 的水解程度,
的水解程度,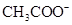 与
与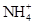 浓度的大小关系是:
浓度的大小关系是: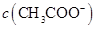
 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.相同浓度的两溶液中c(H+)相同 |
| B.100mL 0.1mol/L的两溶液能中和等物质的量的氢氧化钠 |
| C.pH=3的两溶液稀释100倍,pH都为5 |
| D.两溶液中分别加人少量对应的钠盐,c(H+)均明显减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应中的能量变化通常表现为热量的变化 |
| B.天然气、石油、流水、风力为一次能源。 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:9 | B.1:11 | C.9:1 | D.11:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中不一定含有SO42- |
| B.向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解。 |
| C.等体积的PH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB |
| D.淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(NH4+)<c(SO42-) | B.c(NH4+)=c(SO42-) |
| C.c(NH4+)>c(SO42-) | D.c(SO42-)+ c(OH-)= c(NH4+)+ c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com