
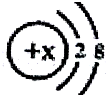 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为:Al(NO3)3.分析 (1)根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;
(2)向15g蒸馏水加入无水硫酸铜粉末,充分搅拌并过滤,得到一定质量的蓝色五水合硫酸铜晶体和8.4g滤液,此温度下无水硫酸铜的溶解度为40g,可以计算出滤液中硫酸铜的质量;
(3)根据难溶的物质在一定条件下可转化成更难溶的物质来分析化学反应.
解答 解:(1)某简单粒子的结构示意图可表示为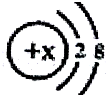 :当X=8时,质子数=8,核外电子数=10,质子数<核外电子数,为氧离子,粒子的符号为O2-;
:当X=8时,质子数=8,核外电子数=10,质子数<核外电子数,为氧离子,粒子的符号为O2-;
当X=11时,质子数=11>核外电子数=10,为钠离子,其离子符号为:Na+;
当X=13时,质子数=13,核外电子数=10,质子数>核外电子数,为铝离子;与硝酸根化合形成的化合物为硝酸铝,铝元素显+3价,硝酸根显-1价,其化学式为:Al(NO3)3,
故答为:O2-;Na+;Al(NO3)3;
(2)向15g蒸馏水加入无水硫酸铜粉末,充分搅拌并过滤,得到一定质量的蓝色五水合硫酸铜晶体和8.4g滤液,此温度下无水硫酸铜的溶解度为40g,设滤液中含硫酸铜的质量为x,则 $\frac{40}{100+40}=\frac{x}{8.4}$,x=2.4g
则滤液中含水的质量为8.4g-2.4g=6g,
故五水合硫酸铜晶体(CuSO4•5H2O)中含水的质量为15g-6g=9g,则含硫酸铜的质量为9g×=16g,
此无水硫酸铜的质量是2.4g+16g=18.4g,
故答案为:18.4g;
(3)由难溶的物质在一定条件下可转化成更难溶的物质,在成有氯化银沉淀的试管中加入碘化钾溶液,振荡后可观察到白色沉淀逐渐变为黄色沉淀,是因为AgI比AgCl更难溶,其反应为AgCl+KI═AgI↓+KCl,
故答案为:AgCl+KI═AgI↓+KCl,AgI比AgCl更难溶.
点评 本题考查学生利用信息来判断反应的发生,掌握五水合硫酸铜晶体的成分、溶解度的含义,抓住习题中的信息利用物质的溶解性来分析反应是解答的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
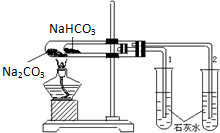 实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:
实验室利用如图所示装置进行Na2CO3和NaHCO3热稳定性对比实验.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Ag | C | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
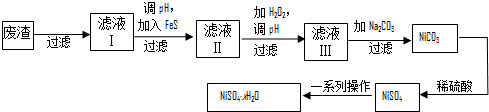
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2加入H218O中:2Na2O2+2H218O=4Na++4OH-+18O2↑ | |
| B. | 0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 向Ca(HCO3)2溶液中加入澄清石灰水:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 向FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com