
| A. | 轮船水线以下的船壳上装一定数量的锌块 | |
| B. | 铝片不用特殊方法保存 | |
| C. | 纯锌与稀硫酸反应时,滴入少量浓H2SO4溶液后速率加快 | |
| D. | 镀锌铁不如镀锡铁耐用 |
分析 A、Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳;
B、铝片因在空气中被O2氧化,使铝片表面形成一层致密的氧化物薄膜而保护内层的铝不再被氧化;
C、硫酸浓度增大,Zn与H2SO4的反应速率加快;
D、镀锌铁破损后Zn比Fe活泼,Zn被腐蚀,而镀锡铁破损后Fe比Sn活泼,铁被腐蚀.
解答 解:A、轮船水线下的船壳装上锌块后,可保护船壳在海水中不被腐蚀,因为Zn比Fe活泼,Zn与Fe构成原电池,在海水中锌被腐蚀,从而保护船壳,发生原电池反应可用电化学知识解释,故A正确;
B、铝片因在空气中被O2氧化,使铝片表面形成一层致密的氧化物薄膜而保护内层的铝不再被氧化,所以铝片不用特殊方法保存,此现象与电化学知识无关,故B错误;
C、纯Zn和稀H2SO4反应速率慢,滴入少量浓H2SO4溶液后,硫酸浓度增大,加快Zn与H2SO4的反应速率,此现象与电化学知识无关,故C错误;
D、镀锌铁发生金属被腐蚀现象时,因Zn比Fe活泼,Zn被腐蚀,镀锡铁破损后发生电化腐蚀,因Fe比Sn活泼,因而是铁被腐蚀,所以,镀锌铁比镀锡铁耐用,发生原电池反应而可用电化学知识解释,但结论错误,故D错误;
故选A.
点评 本题考查了化学腐蚀和电化腐蚀的实质分析,原电池的形成条件是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
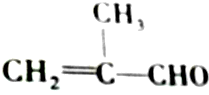 的化学性质叙述错误的是( )
的化学性质叙述错误的是( )| A. | 既能发生氧化反应,又能发生还原反应 | |
| B. | 1 mol该物质只能与1 mol Br2发生加成反应 | |
| C. | 能发生加聚反应 | |
| D. | 能将新制的Cu(OH)2氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
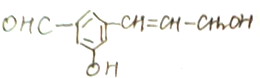 在下列反应中生成的有机物的结构简式.
在下列反应中生成的有机物的结构简式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
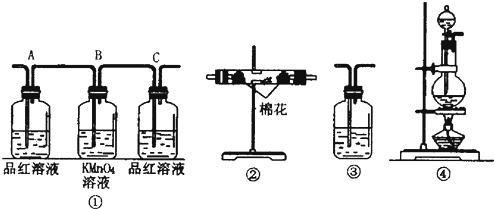
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol/L | B. | 0.1 mol/L | C. | 0.01 mol/L | D. | 10 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(SO32-)>c(OH-)>c(HSO3-) | B. | c(OH-)=c(HSO3-)+2c(H2SO3)+c(H+) | ||
| C. | 加入少量NaOH固体,Kw增大 | D. | 加入稀盐酸,c(HSO3-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
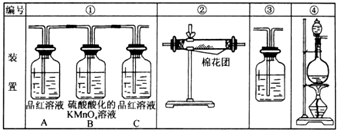 (1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O
(1)浓硫酸与木炭粉在加热条件下反应的化学方程式是:C+2H2SO4(浓)=CO2↑+2SO2↑+2H2O查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com