
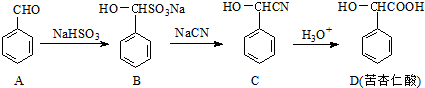
 .
. 分析 A含有醛基,与亚硫酸氢钠发生加成反应生成B,B与NaCN发生取代反应生成C,C发生水解反应生成苦杏仁酸,
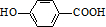
D含有羟基和羧基,可发生缩聚反应,E能发生如下水解反应:E+H2O$\stackrel{稀酸}{→}$CH3OH+F,可知E含有酯基,可水解生成F含有羧基,F中含有-OH和-COOH,可为邻、间、对3种,F核磁共振氢谱有4组峰且面积比为1:2:2:1,应为 ,以此解答该题.
,以此解答该题.
解答 解:A含有醛基,与亚硫酸氢钠发生加成反应生成B,B与NaCN发生取代反应生成C,C发生水解反应生成苦杏仁酸,
①对比A、B结构简式可知,含有醛基,与亚硫酸氢钠发生加成反应生成B,故答案为:加成反应;
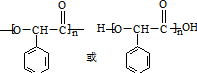
②含有羟基和羧基,可发生缩聚反应,生成物为 ,故答案为:
,故答案为: ;
;
③E能发生如下水解反应:E+H2O$\stackrel{稀酸}{→}$CH3OH+F,可知E含有酯基,可水解生成F含有羧基,F中含有-OH和-COOH,可为邻、间、对3种,F核磁共振氢谱有4组峰且面积比为1:2:2:1,应为 ,
,
故答案为:3; .
.
点评 本题考查以有机物合成考查有机物结构与性质,为高频考点,涉及同分异构体及醛、羧酸性质的考查,把握官能团与性质的关系即可解答,题目难度不大


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{1}^{1}$H和${\;}_{1}^{2}$H | B. | 金刚石和石墨 | ||
| C. | CH3CH2OH和CH3OCH3 | D. | CH4和C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PO43- | B. | CCl4 | C. | NO3- | D. | SiH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3═CaO+CO2↑ | B. | NaHCO3+NaOH═Na2CO3+H2O | ||
| C. | Ca(ClO)2+CO2+H2O═CaCO3↓+2HClO | D. | 3K2MnO4+2H2O═2KMnO4+MnO2↓+4KOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用KSCN溶液检验FeCl2是否已被氧化而变质 | |
| B. | 用焰色反应鉴别NaCl和KCl | |
| C. | 用加热法除去Na2CO3中混有的NaHCO3杂质 | |
| D. | 用NaOH溶液除去MgCl2溶液中的CuCl2杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,立即用水灭火 | |
| B. | 配制稀硫酸时将水倒入浓硫酸中 | |
| C. | 用点燃的火柴在液化气钢瓶口检验是否漏气 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处走 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.
金属及其化合物在化学中扮演着重要的角色,同学们应该熟练掌握它们的性质.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com