
分析 (1)2K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中,Cr元素的化合价由+6价降低为+3价,Cl元素的化合价由-1价升高为0;
(2)N元素化合价降低,C元素化合价升高,根据电子守恒和原子守恒配平方程式;
(3)反应中N元素的化合价降低,C元素的化合价升高,Al元素的化合价不变.
解答 解:(1)2K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O中,Cr元素的化合价由+6价降低为+3价,则K2Cr2O7为氧化剂,Cl元素的化合价由-1价升高为0,则HCl为还原剂,该反应中转移6e-,生成KCl、CrCl3体现盐酸的酸性,生成Cl2体现盐酸的还原性,
故答案为:K2Cr2O7;酸性、还原性;
(2)反应中N元素的化合价降低,C元素的化合价升高,Al元素的化合价不变,则方程式为Al2O3+N2+3C$\frac{\underline{\;一定条件\;}}{\;}$2AlN+3CO;
故答案为:1,1,3,2,3;
(3)反应中N元素的化合价降低,氮气为氧化剂,其还原产物为AlN,C元素的化合价升高,C为还原剂,
故答案为:C;AlN.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,注意从化合价角度分析,侧重氧化还原反应中基本概念及转移电子的考查,题目难度不大.


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3COONa的溶液:CH3COO-+H2O═CH3COOH+OH- | |
| B. | NH4Cl的溶液:NH4++H2O?NH3•H2O+H+ | |
| C. | Na2CO3的溶液:CO32-+H2O?H2CO3+2OH- | |
| D. | AlCl3的溶液:Al3++3H2O═Al(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
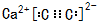 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥⑧ | B. | ③④⑥⑦ | C. | ④⑤⑥⑧ | D. | ③④⑥⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体中分散质粒子直径大小在1~100 nm之间 | |
| B. | 可以利用丁达尔效应区分胶体和溶液 | |
| C. | 可利用过滤的方法分离胶体和溶液 | |
| D. | 胶体在一定条件下可以稳定存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com