
| A. | 同素异形体:是否由同一种原子构成 | |
| B. | 纯净物和混合物:是否只含一种元素 | |
| C. | 电解质和非电解质:溶于水或熔融状态下能否导电 | |
| D. | 氧化还原反应:元素化合价是否变化 |
分析 A.同种元素的不同单质为同素异形体;
B.只由一种物质组成的数以纯净物;
C.溶于水和熔融状态下都不能导电的化合物为非电解质;
D.氧化还原反应的实质为电子转移,特征为化合价变化.
解答 解:A.同种元素的不同单质为同素异形体,不能利用原子判断,故A错误;
B.氧气和臭氧也只有一种元素,但数以混合物,故B错误;
C.溶于水和熔融状态下都不能导电的化合物为非电解质,且电解质与非电解质均为化合物,不能利用溶于水或熔融状态下能否导电判断,故C错误;
D.氧化还原反应的实质为电子转移,特征为化合价变化,则氧化还原反应的判断依据为元素化合价是否变化,故D正确,
故选D.
点评 本题考查化学反应及物质的分类,涉及氧化还原反应、电解质、碱性氧化性及同素异形体,为高频考点,把握相关概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
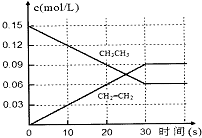 乙烯是重要的化工原料,用乙烷脱氢制乙烯:
乙烯是重要的化工原料,用乙烷脱氢制乙烯:| 化学键 | C-H | C-C | C=C | H-H |
| 键能(kJ.mol-1) | 412 | 348 | 612 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸和碳酸钙反应:2H++CO32-═H2O+CO2↑ | |
| B. | 锌片插入硝酸根溶液中:Zn+Ag+═Zn2++Ag | |
| C. | 铜和稀硝酸反应:Cu+2NO3-+4H+═Cu2++2NO2↑+2H2O | |
| D. | 氯气和氢氧化钠溶液反应:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

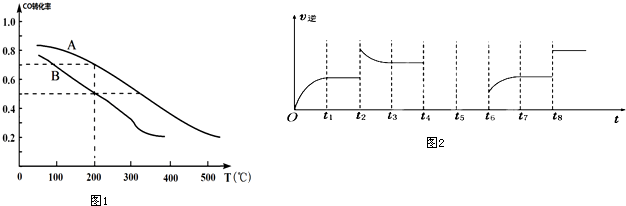
| A. | 密闭容器中反应达到平衡,t0时改变某一条件有如图变化所示,则改变的条件只能是加入催化剂 | |
| B. | 反应达到平衡时外界条件对平衡影响关系如图B所示,则正反应为放热反应,且a>b | |
| C. | 物质的量和温度关系如图C所示,则该反应的正反应为放热反应 | |
| D. | 反应速率和反应条件变化关系如图D所示,则该反应的正反应为放热反应,且A、B、C、D均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸除水垢:2CH3COO-+2H++CaCO3═(CH3COO)2Ca+CO2↑+H2O | |
| B. | 澄清石灰水中滴加少量NaHCO3:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- | |
| C. | 稀硫酸除铜绿:4H++Cu2(OH)2CO3═2Cu2++CO2↑+3H2O | |
| D. | 酸性条件下KIO3与KI溶液反应:IO3-+5I-+3H2O═3I2+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K1>K2>K1′>K2′ |
| 298 | K1 | K2 | |
| 328 | K1′ | K2′ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
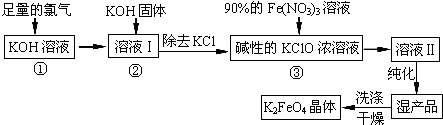
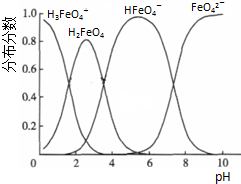
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应,熵增加 | B. | 放热反应,熵减小 | C. | 吸热反应,熵增加 | D. | 吸热反应,熵减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com