
等物质的量下列各状态的电解质,自由离子数由大到小的排列顺序是( )
①熔融的NaHSO4 ②NaHSO4溶液 ③NaHCO3溶液 ④H2CO3溶液
A.①②③④ B.④②③①
C.②③①④ D.②①③④
科目:高中化学 来源: 题型:
普伐他汀是一种调节血脂的药物,其结构简式如图所示
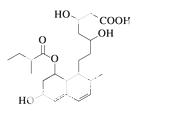 (未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是 ( )
(未表示出其空间构型)。下列关于普伐他汀的性质描述正确的是 ( )
A.能与FeCl3溶液发生显色反应
B.不能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1 mol该物质最多可与1 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物X和Y可作为“分子伞”给药物载体的伞面和中心支撑架(未表示出原子或原子团的空间排列)
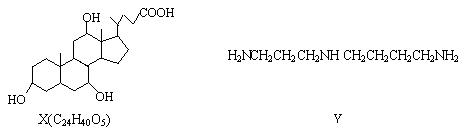

下列叙述错误的是( )
A.1molX在浓硫酸作用下发生消去反应,最多生成3molH2O
B.1molY发生类似酯化的反应,最多消耗2molX
C.X与足量HBr反应,所得有机物的分子式为C24H37O2Br3
D.Y与癸烷的分子链均呈锯齿形,但Y的极性较强
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属 质量/g | 金属 状态 | c(H2SO4) /mol·L-1 | V(H2SO4) /mL | 溶液温度/℃ | 金属消失的时间/S | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.1 | 粉末 | 0. 8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 |
| 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 20 | 44 | 40 |
分析上述数据,回答下列问题:
(1) 实验4和5表明_________对反应速率有影响;________,反应速率越快,能表明这一规律另一组实验是___________(填实验序号)。
(2) 在前4次实验中,能表明反应物浓度对反应速率产生影响的实验有________(填实验序号)。
(3) 本实验中影响反应速率的其他因素还有_________,其实验序号是_____。
(4) 实验中,反应前后溶液的温度变化值(约15℃)相近,推测其原因:
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将①H+ ②Cl- ③Al3+ ④K+ ⑤S2- ⑥OH- ⑦NO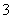 ⑧NH
⑧NH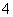 分别加入H2O中,基本上不影响水的电离平衡的是( )
分别加入H2O中,基本上不影响水的电离平衡的是( )
A.①③⑤⑦⑧ B.②④⑦
C.①⑥ D.②④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
有关①100mL 0.1mol/L NaHCO3 ②100mL 0.1mol/L Na2CO3两种溶液的叙述不正确的是( )
A.溶液中水电离出的H+个数:②>①
B.溶液中阴离子的物质的量浓度之和:②>①
C.①溶液中:c(CO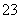 )>c(H2CO3)
)>c(H2CO3)
D.②溶液中:c(HCO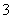 )>c(H2CO3)
)>c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”。某研究性学习小组拟对融雪氯盐(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究。
| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
该小组设计流程如图:
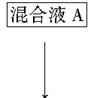
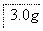
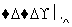

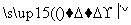
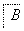
(1)加入混合液A的主要成分是________________(填化学式)。
(2)为检验溶液B中的Mg2+、Ca2+,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+,向其中一支试管中加入________溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+,向另一支试管中加入某溶液,看是否有沉淀生成。下列三种溶液,其沉淀效果最好的是________。
A.0.1mol·L-1 Na2CO3溶液
B.0.1mol·L-1 Na2SO3溶液
C.0.1mol·L-1 Na2C2O4溶液
(3)在除杂过程中,向粗盐悬浊液中加混合液A时需控制溶液pH=12以确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在________________以下。
(4)对溶液B加热并不断滴加6mol·L-1的盐酸,同时用pH试纸检测溶液,直至pH=2时停止加盐酸,得到溶液C。该操作的目的是__________________________________________________。
(5)溶液C倒入蒸发皿中,加热蒸发并用玻璃棒不断搅拌,直到有大量固体析出时停止加热。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中,能发生银镜反应,滴入紫色石蕊试液不变色,加入少量氢氧化钠溶液,再加入酚酞试液变红色,共煮后红色变浅的是( )
A.乙酸甲酯 B.甲酸乙酯
C.硬脂酸 D.油酸甘油酯
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,向2 L恒容密闭容器中充入1.0 mol A和1.0 mol B,反应A(g)+B(g)C(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表,下列说法正确的是( )
| t/s | 0 | 5 | 15 | 25 | 35 |
| n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.反应在前5 s的平均速度v(A)=0.17 mol·L-1·s-1
B.保持其他条件不变,升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH>0
C.相同温度下,起始时向容器中充入2.0 mol C,达到平衡时,C的转化率大于80%
D.相同温度下,起始时向容器中充入0.20 mol A、0.20 mol B和1.0 mol C,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com