
| A. | ①②③ | B. | ①⑤⑥ | C. | ②③④ | D. | ③⑤⑥ |
分析 可用sp2杂化轨道来解释说明中心原子杂化轨道数目为3,杂化轨道数目=σ键+孤电子对数.
解答 解:①BF3分子中B原子孤电子对数=$\frac{1}{2}$×(3-3×1)=0,杂化轨道数目为3+0=3,B原子杂化类型为sp2,故①正确;
②CH2═CH2分子中碳原子孤电子对数=$\frac{1}{2}$×(4-2-2)=0,杂化轨道数为3+0=3,C原子采取sp2杂化,故②正确;
③苯分子中C原子形成3个σ键,没有孤对电子,杂化轨道数为3,所以采取sp2杂化,故③正确;
④CH≡CH分子中每个碳原子形成1个C-H,1个C≡C三键,没有孤对电子,杂化轨道数目为2,碳原子采取sp杂化,故④错误;
⑤NH3中N原子形成3个σ键,含有1对孤对电子,杂化轨道数为4,N原子采取sp3杂化,故⑤错误;
⑥CH4中碳原子形成4个σ键,没有孤对电子,杂化轨道数为4,C原子采取sp3杂化,故⑥错误;
故选A.
点评 本题考查原子杂化类型的判断,杂化轨道形成σ键或填充孤电子对,杂化轨道数目=σ键+孤电子对数,注意孤电子对的计算,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 铁丝在空气中被点燃,火星四射 | |
| B. | 氧化铁放入氢氧化钠溶液中,生成红褐色沉淀 | |
| C. | 点燃氢气和一氧化碳的混合气体,发生猛烈爆炸 | |
| D. | 氯化铜溶液中滴入氢氧化钠溶液,产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤中含有苯、二甲苯等,因此可以通过煤的干馏得到,并将它们分离 | |
| B. | 酒精消毒原理是将病毒彻底氧化 | |
| C. | 绿色化学的核心是利用化学原理治理环境污染 | |
| D. | 麦芽糖的水解产物能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有8个副族 | B. | 元素周期表有7个周期 | ||
| C. | 短周期是指第一、二周期 | D. | IA族的元素全部是金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
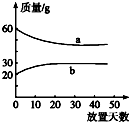 浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )
浓硫酸和2mol•L-1的稀硫酸,在实验室中敞口放置.它们的质量和放置天数的关系如图,分析a、b曲线变化的原因是( )| A. | a升华、b冷凝 | B. | a冷凝、b吸水 | C. | a挥发、b潮解 | D. | a挥发、b吸水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能生成碱的金属元素都在ⅠA族 | |
| B. | 原子序数为14的元素位于元素周期表的第3周期ⅣA族 | |
| C. | 稀有气体元素原子的最外层电子数均为8 | |
| D. | 最外层电子数是次外层电子数的2倍的原子容易失去电子成为阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 | |
| B. | 只含有一种元素的物质都是纯净物 | |
| C. | 制糖工业中利用活性炭脱色制白糖的过程是物理变化 | |
| D. | 压强恒定时,气体在水中的溶解度随温度的升高而降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| B. | 已知S(s)+O2(g)═SO2(g)△H1;S(g)+O2(g)=SO2(g)△H2,则△H1>△H2 | |
| C. | 已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol,则氢气的燃烧热为241.8kJ/mol | |
| D. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全中和,中和热为28.65kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2、NH3、SO3 | B. | CO2、CH4、C2H5OH | C. | NO、CaO、Ne | D. | P4、CS2、Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com