
在20℃时,从100g的饱和KNO3溶液中取出10g溶液,剩余溶液跟原溶液比较,有关的量没有发生变化的是(双选)……( )
A、溶质的质量 B、溶剂的质量 C、溶液密度 D、溶质质量分数
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
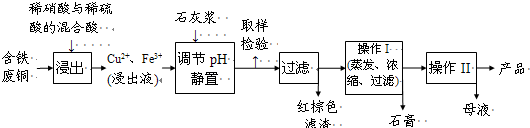
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
| 162.5cV |
| m |
| 162.5cV |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(S)浓度 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A)mol?L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
| c(B)mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |

| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | ||
| B、饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 | ||
C、在
| ||
| D、在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com