
向50 mL Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51 g白色沉淀,向白色沉淀中加入过量的稀HNO3,充分反应后,沉淀减少到4.66 g,并有气体产生。
(1)原混合溶液中Na2SO4和Na2CO3的物质的量浓度各是多少?
(2)产生的气体的物质的量为多少?
科目:高中化学 来源: 题型:
下列有关化学用语表示规范正确的是
A.乙烯的结构简式:C2H4 B.中子数为20的钾原子: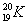
C.次氯酸的结构式:H—O—Cl D.氯化钠的分子式:NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室欲配制0.1mol/L NaOH溶液并进行有关性质实验,请据此回答下列问题
(1)若实验过程中遇到下列情况,则会造成所配溶液的浓度偏低的是 (填字母)
a.加水时越过刻度线
b.未洗涤烧杯和玻璃棒
c.容量瓶内壁附有水珠而未干燥处理
d.定容时俯视刻度线
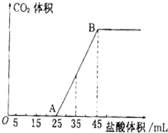
(2)向VmL上述浓度的NaOH溶液中,通入一定量的CO2后,然后向该溶液中逐滴中入1mol?L-1的盐酸,所加入盐酸溶液的体积与产生CO2的体积关系如图所示:
①当加入45mL盐酸溶液时,产生二氧化碳的物质的量为
②计算所取氢氧化钠溶液的体积V= mL
(3)取上述氢氧化钠溶液100mL,加入足量的铝,该反应的离子方程式为
反应生成的气体的物质的量为
查看答案和解析>>
科目:高中化学 来源: 题型:
已知8 g A能与32 g B恰好完全反应,生成22 g C和一定量D,现将16 g A与70 g B的混合物充分反应后,生成2 mol D和一定量的C,则D的摩尔质量为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的a L HCl (g)溶于1000 g水中,得到的盐酸密度为b g·cm―3,则该盐酸的物质的量浓度是( )
A.a/22.4 mol·L―1 B.ab/22400 mol·L―1
C.ab/(22400+36.5 a) mol/L D.1000 ab/(22400+36.5 a) mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
4℃时,若20滴水恰好1 mL,那么1滴水中所含的水分子数约为(NA表示阿伏加德罗常数的值)( )
A.20 NA B.NA/360
C.9 NA/10 D.360/NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图装置制取表中的四种干燥、纯净的气体(图中铁架台、铁夹、加热及气体收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。
其中正确的是( )
| 选项 | 气体 | a | b | c | d |
| A | CO2 | 盐酸 | CaCO3 | 饱和Na2CO3 溶液 | 浓硫酸 |
| B | Cl2 | 浓盐酸 | MnO2 | NaOH溶液 | 浓硫酸 |
| C | NH3 | 饱和NH4Cl 溶液 | 消石灰 | H2O | 固体NaOH |
| D | NO | 稀硝酸 | 铜屑 | H2O | 浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ba(NO3)2可用于生产绿色烟花、绿色信号弹、炸药、陶瓷釉药等。钡盐生产中排出大量的钡泥[主要含有BaCO3、BaSO3、Ba (FeO2)2等],某主要生产BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),其部分工艺流程如下:
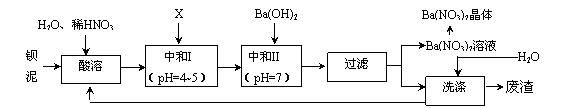
已知:①Fe3+和Fe2+以氢氧化物形式沉淀完全时,溶液的pH分别为3.2和9.7;
②Ba(NO3)2晶体的分解温度:592℃;
③kSP(BaSO4)=l.l×l 0-10,kSP (BaCO3)=5 .l×l0-9。
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤。试用离子方程式说明提纯原理_____________________________________________________________。
(2)上述流程中酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,反应的化学方程式为_______________________________________________。
(3)该厂结合实际,图中X应选用_____________(填字母)。
A.BaCl2 B.BaCO3 C.Ba(NO3) 2 D.Ba(OH) 2
(4)中和I使溶液的pH为4~5的目的是________________________________;结合离子方程式简述其原理:________________________________。
(5)从Ba(NO3)2溶液中获得其晶体的操作方法是_____________________。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取wg晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m g,则该晶体的纯度为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com