
分析 Mg2+、Ag+均与NaOH反应生成沉淀,Mg2+、Ag+、Ba2+均与Na2CO3反应生成沉淀,结合每次只加一种溶液,滤出一种沉淀来解答.
解答 解:Mg2+、Ag+均与NaOH反应生成沉淀,Mg2+、Ag+、Ba2+均与Na2CO3反应生成沉淀,因每次只加一种溶液,滤出一种沉淀,则先加NaCl,生成AgCl沉淀,再加NaOH,生成氢氧化镁沉淀,最后加碳酸钠,生成碳酸钡沉淀,则所加溶液的正确顺序是NaCl、NaOH、Na2CO3,
故答案为:NaCl、NaOH、Na2CO3.
点评 本题考查离子的检验及分离,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
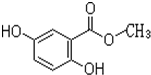 .
.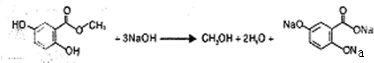 .
.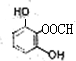 、
、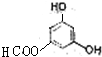 .
.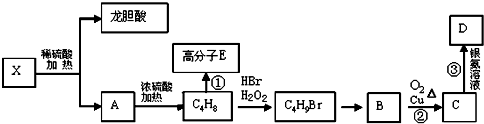
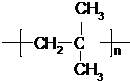 .
.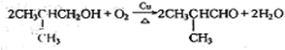 .
.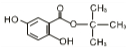 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
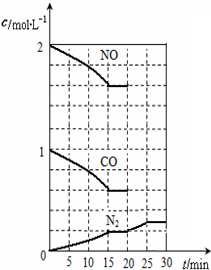 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| B. | 用碱式滴定管量取25.00mL高锰酸钾溶液 | |
| C. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
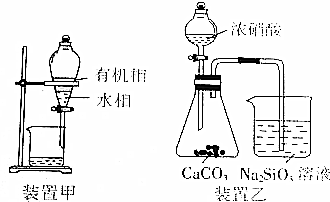
| A. | 制备Fe(OH)3胶体:向0.1mol•L-1FeCl3溶液中加适量NaOH溶液并煮沸片刻 | |
| B. | 用装置甲分液,放出水相后再从分液漏斗下口放出有机相 | |
| C. | 用装置乙进行实验,证明酸性:硝酸>碳酸>硅酸 | |
| D. | 探讨改变浓度研究反应“2Fe3++2I-?2Fe2++I2”中Fe3+和Fe2+的相互转化:向3mL 0.05mol•L-1Fe2(SO4)3溶液中加入3 mL 0.01mol•L-1 KI溶液,将所得黄色溶液等分成三份,第一份加入数滴0.01 mol•L-1AgNO3溶液,第二份加入1mL0.01mol•L-1FeSO4溶液,第三份加1mL水,观察并比较实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
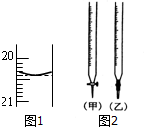 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 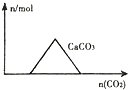 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 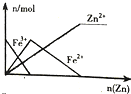 向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. | 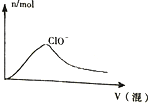 HCl与Cl2的混合通入NaOH溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com