


| 实验 | 主要实验步骤及实验现象 |
| 1 | 向Y溶液中加入稀H2SO4,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色. |
| 2 | 向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解. |
| 3 | 向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀. |


| 水解 |
| 水解 |
 ,故答案为:过氧化钠;
,故答案为:过氧化钠; ;
;| 水解 |
| 水解 |


 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 | 主要实验步骤及实验现象 |
| 1 | 向Y溶液中加入稀H2SO4,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色. |
| 2 | 向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解. |
| 3 | 向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀. |
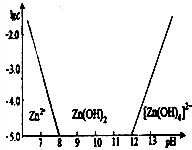
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| 实验 | 主要实验步骤及实验现象 |
| 1 | 向Y溶液中加入稀H2SO4,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色. |
| 2 | 向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解. |
| 3 | 向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀. |


查看答案和解析>>
科目:高中化学 来源:2011年福建省泉州市晋江市季延中学高考化学模拟试卷(一)(解析版) 题型:解答题
| 实验 | 主要实验步骤及实验现象 |
| 1 | 向Y溶液中加入稀H2SO4,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色. |
| 2 | 向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解. |
| 3 | 向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀. |

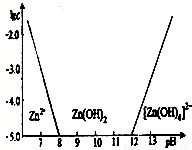
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com