
| A. | 浓硫酸可用于干燥NH3、H2、O2等气体 | |
| B. | 二氧化硫可用来漂白纸浆、毛、丝等 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 干冰升华没有断裂化学键 |
分析 A.干燥剂不能和被干燥的气体发生反应,浓硫酸具有酸性和强氧化性,不能干燥碱性和部分还原性气体;
B.二氧化硫能和某些有色物质反应生成无色物质而体现漂白性;
C.离子化合物中一定含有离子键,可能含有共价键;
D.分子晶体发生物理变化时只破坏分子间作用力.
解答 解:A.干燥剂不能和被干燥的气体发生反应,浓硫酸具有酸性和强氧化性,不能干燥碱性和部分还原性气体,氨气属于碱性气体,能和浓硫酸反应生成硫酸铵,所以不能用浓硫酸干燥氨气,故A错误;
B.二氧化硫能和某些有色物质反应生成无色物质而体现漂白性,则二氧化硫可用来漂白纸浆、毛、丝等,故B正确;
C.离子化合物中一定含有离子键,可能含有共价键,所以含有离子键的化合物中一定是离子化合物,故C正确;
D.干冰是共价化合物,为分子晶体,分子间只存在分子间作用力,分子晶体发生物理变化时只破坏分子间作用力,所以干冰升华只破坏分子间作用力,故D正确;
故选A.
点评 本题考查物质组成结构和性质,为高频考点,涉及气体干燥、元素化合物性质、化学键和分子间作用力等知识点,明确物质构成微粒、物质性质是解本题关键,注意化学键和分子间作用力的区别,易错选项是D.


科目:高中化学 来源: 题型:选择题
| A. | 茶 | B. | 西瓜 | C. | 大豆 | D. | 甜菜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提出原子结构模型的科学家按时间先后依次是:道尔顿、汤姆生、卢瑟福、玻尔 | |
| B. | 已知PM2.5是指大气中直径≤2.5×10-6m的颗粒物,则受PM2.5污染的大气不一定能产生丁达尔现象 | |
| C. | 借助仪器来分析化学物质的组成是常用的手段,原子吸收光谱常用来确定物质中含有哪些非金属元素 | |
| D. | 并不是所有金属元素都可以用焰色反应来确定其存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
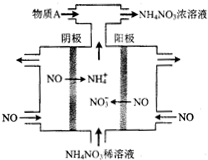
| A. | NO是常见的大气污染物之一,该装置可实现废气的治理与回收利用 | |
| B. | 阳极反应为:NO-3e-+2H2O═NO3-+4H+ | |
| C. | 阴极反应为:NO+5e-+6H+═NH4++H2O | |
| D. | 为使电解产物全部转化为NH4NO3,需向该电解池中补充水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
. .其中心原子的杂化类型为sp3.
.其中心原子的杂化类型为sp3. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 1L某混合溶液,可能含有的离子如表:
1L某混合溶液,可能含有的离子如表:| 可能大量含有的阳离子 | H+、NH4+、Al3+、K+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、ClO-、AlO2- |
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com