
分析 原子的得电子能力越强,其电负性的数值越大;原子个数相等且价电子数相等的分子或离子为等电子体;根据NH4+中中心原子的价层电子对数判断;根据NH4Cl中微粒之间的作用力分析;分子晶体相对分子质量相近的,含有氢键的熔点较高;原子晶体中共价键键能越大,熔点越高,据此分析.
解答 解:元素原子的得电子能力越强,则电负性越大,同周期从左到右元素的电负性逐渐增强,所以电负性:O>N>C;
原子个数相等且价电子数相等的分子或离子为等电子体,则O3的一种分子形式的等电子体为SO2;
NH3分子中有N原子形三个共价键,含有一个孤电子对;
NH4+的N原子的价层电子对数=4+$\frac{5-1-1×4}{2}$=4,没有孤电子对,其空间构型是正四面体;NH4Cl中N与H形成共价键,铵根离子与氯离子形成离子键,铵根离子中含有配位键;NH4Cl含有离子键,属于离子晶体;
乙醇分子间存在氢键,乙烷分子间只有分子间作用力,所以熔点乙醇大于乙烷;SiC中共价键的键能大于Si,所以熔点SiC大于Si; SiCl4属于分子晶体,SiO2属于原子晶体,原子晶体的熔点大于分子晶体,所以熔点:SiCl4 小于SiO2;
故答案为:O>N>C;SO2;1;正四面体;配位键;离子键;离子晶体;>;>;<.
点评 本题考查较综合,涉及电负性比较、微粒空间构型的判断、分子间作用力、化学键等知识点,题目涉及的知识点较多,同时考查学生分析能力和对基础知识的应用能力,难度中等.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:解答题
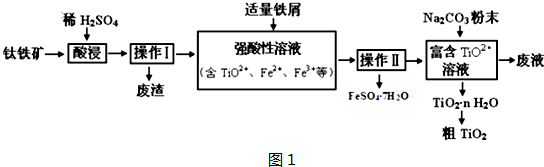
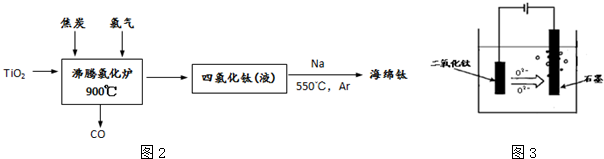
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 制备方法 | 具体内容 |
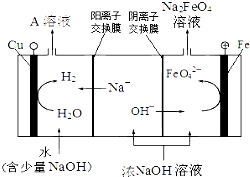
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾和KNO2等产物 |
| 湿法 | 强碱性介质中,Fe(NO3)3与KClO反应生成紫红色高铁酸钾溶液 |
| 电解法 | 电解浓NaOH溶液制备Na2FeO4 |
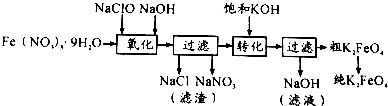
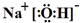 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
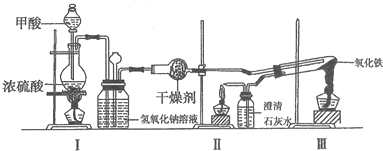
| 加热方式 | 产物元素组成 | 各元素的质量分数% | |
| Fe | O | ||
| 酒精灯 | Fe和O | 74.50 | 25.50 |
| 带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
| 酒精喷灯 | Fe | 100.00 | 0.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
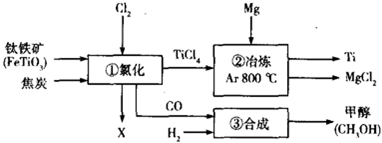
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.
甲醇是一种可再生的绿色能源,CO2是一种温室气体,它们都是重要的化工原料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:| K2CO3 | KHCO3 | K2SO4 | KMnO4 | |
| 溶解度/g | 111 | 33.7 | 11.1 | 6.34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C+O2 $\frac{\underline{\;点燃\;}}{\;}$CO2 化合反应 | |
| B. | CaCO3$\frac{\underline{\;点燃\;}}{\;}$ CaO+CO2↑分解反应 | |
| C. | AgNO3+KCl═AgCl↓+KNO3复分解反应 | |
| D. | Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量悬浊液,过滤,充分洗涤后,取滤渣于试管中,加入过量2mol/L的盐酸溶液,充分振荡,再滴加几滴0.1mol/L氯化钡溶液 | 有白色沉淀生成说明悬浊液中混有Cu4(OH)6SO4. |
| 步骤2:另取少量悬浊液于试管中,将试管放入装有沸水的小烧杯中水浴加热一段时间取出试管观察 | 试管中有黑色固体生成,说明悬浊液中混有Cu(OH)2. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com