
【题目】能使湿润的KI淀粉试纸变蓝的是( )
①氯水 ②溴水 ③碘水 ④氯化钠 ⑤溴化钾
A. ①② B. ①②③ C. ①②④ D. ①③⑤
科目:高中化学 来源: 题型:
【题目】向足量的500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应。试计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和溶液的物质的量浓度。
(3)生成标准状况下H2的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与1.0 L 0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与1.0 L 0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
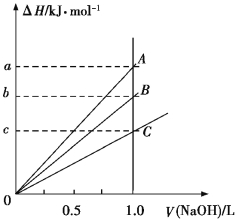
A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究一种无机盐X(仅含有五种元素,且含有结晶水)的组成和性质。设计并完成了如下实验:

另将生成的气体甲与过量灼热氧化铜粉末反应,生成两种单质,再将产物通入浓硫酸洗气后测得标况下的气体乙为0.224 L。请回答如下问题:
(1)X的化学式是________________。
(2)溶液2中通入过量气体甲时发生的离子反应方程式有:
__________________________________ ; ________________________________。
(3)在一定条件下,生成的气体甲与过量氧化铜还能发生另一氧化还原反应,生成的气体乙在标况下的体积仍为0.224 L,写出该反应的化学方程式: ____________________________。
(4)请设计实验证明无机盐X中存在的金属阳离子___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置(X、Y是直流电源的两极)分别进行下列各组实验,则下表中所列各项对应关系均正确的一组是( )
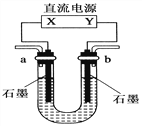
选项 | 电源 X极 | 实验前U形管中液体 | 通电后现象及结论 |
A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞试液后,a管中呈红色 |
B | 正极 | AgNO3溶液 | b管中电极反应式是4OH--4e-===2H2O+O2↑ |
C | 负极 | KCl和CuCl2混合溶液 | 相同条件下,a、b两管中产生的气体总体积可能相等 |
D | 负极 | Fe(OH)3胶体和导电液 | b管中液体颜色加深 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D和E五种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子,又知B、C和D是由两种元素的原子组成,且D分子中两种原子个数比为1∶1。请回答:
(1)组成A分子的原子的核外电子排布式是________ ;
(2)B和C的分子式分别是________和________;C分子的立体结构呈________形,该分子属于________分子(填“极性”或“非极性”);
(3)向D的稀溶液中加入少量氯化铁溶液现象是________,该反应的化学方程式为 ________;
(4)若将1 moL E在氧气中完全燃烧,只生成1 mol CO2和2 mol H2O,则E分子的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下物质:①食盐水②二氧化碳③盐酸④蔗糖⑤熔融的硫酸钾⑥氧气⑦纯醋酸⑧金属铜⑨碳酸氢钠固体⑩氢氧化钠固体。请回答下列问题(用序号填写)
(1)能导电的是 __________________________________;
(2)属于电解质的是________________,属于非电解质的是__________________。
(3)写出相关电解质的电离方程式 ____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将14.2g Na2SO4完全溶于水中,配成500 mL溶液,其物质的量浓度为__________;若从中取出50 mL,Na+物质的量浓度为___________;若将这50 mL溶液用水稀释至100 mL,所得溶液中SO42-的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(FeCO3)是一种重要的工业盐。某学习小组对用FeSO4制备FeCO3
资料显示:FeCO3:白色结晶,难溶于水;干燥品在空气中稳定,湿品暴露在空气中缓慢氧化生成红棕色的水合氧化铁FeO(OH。
(1)实验探究Ⅰ
实 验 Ⅰ | 操作 | 现象 |
| 1、混合后出现白色絮状沉淀,振荡,部分沉淀呈灰绿色,无气泡产生 2、放置5-8分钟,灰绿色沉淀逐渐增多,最终变成红褐色 |
①生成FeCO3离子方程式:_________________________________。
②反应过程中可能生成Fe(OH)2的依据是__________________________________。
③取沉淀离心、充分洗涤,加足量稀硫酸,沉淀溶解且有气泡产生,证明白色沉淀中含有CO32-;此时溶液中存在的金属阳离子有__________________________________。
(2)实验探究Ⅱ
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、振荡,粘附在试管内壁的白色颗粒状浑浊变红棕色,且越来越多;20分钟后,白色浑浊明显沉降 |
①经检验,试管中白色颗粒状浑浊是FeCO3,请结合化学用语从平衡角度解释产生大量气泡的原因______________________________________________。
②分析现象认为:实验Ⅱ所得固体中FeCO3的含量比实验Ⅰ多。支持该结论的操作及现象如下:分别两种沉淀离心过滤、洗涤、干燥后称取等质量的两种固体,___________________则结论成立。
(3)实验探究Ⅲ
实验Ⅱ | 操作 | 现象 |
| 1、混合后,试管中出现白色颗粒状浑浊,片刻后有大量气泡产生 2、一段时间后将带有气球(排尽空气)的胶塞塞紧试管,振荡后放置5小时,气球膨胀,试管中沉淀物始终保持白色 |
实验改进的意图是____________。
(4)综合以上实验,下列说法正确的是__________
a.用NaHCO3制得FeCO3纯度高的原因之一是因为NaHCO3溶液碱性弱
b.用1 L 1.0 mol/L NaHCO3与足量FeSO4溶液反应理论上可制备116 g FeCO3
c.湿品FeCO3在空气中缓慢氧化的方程式为 4FeCO3+O2+6H2O=4Fe(OH)3+4CO2
d.工业上用NH4HCO3和FeSO4反应可制备纯度更高的FeCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com