
【题目】体积和浓度均为25.00mL0.1mol/LNaI、NaBr及NaCl三种溶液,分别用0.1mol/L的AgNO3溶液滴定,滴定曲线如图所示[pAg=-lgc(Ag+)]。下列说法不正确的是( )
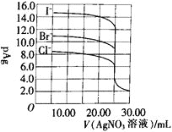
A.Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl)
B.AgNO3溶液滴定Cl-时,可加入少量的KI作滴定指示剂
C.三种溶液等体积等浓度混合后用AgNO3溶液滴定,沉淀顺序为I-、Br-、Cl-
D.当V(AgNO3)=30.00mL时,三种溶液中:c(I-)<c(Br-)<c(Cl-)
【答案】B
【解析】
A.由图象可知,滴加AgNO3溶液10.00mL时,AgNO3少量,溶液中c(Ag+)按I-、Br-、Cl-依次增大,故Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),A正确;
B.滴加硝酸银滴定Cl-时,若用KI作为指示剂,I-优先与Ag+反应生成沉淀,故不能用KI作为滴定指示剂,B错误;
C.由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),三种溶液等体积等浓度混合后用AgNO3溶液滴定,沉淀顺序为I-、Br-、Cl-,C正确;
D.当滴定AgNO3溶液至30.00mL时,c(I-)=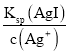 ,c(Br-)=
,c(Br-)=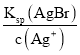 ,c(Cl-)=
,c(Cl-)=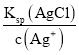 ,由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),则平衡时c(I-)<c(Br-)<c(Cl-),D正确;
,由于Ksp(AgI)<Ksp(AgBr)<Ksp(AgCl),则平衡时c(I-)<c(Br-)<c(Cl-),D正确;
故合理选项是B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应,M(g)+N(g) ![]() R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应
R(g)+2L, 此反应符合下图所示图象。R%为R在平衡混合物中的质量分数,则该反应

A. 正反应是吸热反应,L是气体
B. 正反应是放热反应,L是气体
C. 正反应是吸热反应,L是固体
D. 正反应是放热反应,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示]的化学平衡的影响,得到如图图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
cC(g)表示]的化学平衡的影响,得到如图图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
A. 如图反应:若p1>p2,则此反应只能在高温下自发进行
如图反应:若p1>p2,则此反应只能在高温下自发进行
B. 如图反应:此反应的△H<0,且T1<T2
如图反应:此反应的△H<0,且T1<T2
C. 如图反应:表示t1时刻一定是使用催化剂对反应速率的影响
如图反应:表示t1时刻一定是使用催化剂对反应速率的影响
D. 如图反应:表示t1时刻增大B的浓度对反应速率的影响
如图反应:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g) ![]() 2Z(g) H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是( )
2Z(g) H<0。当改变某个条件并达到新平衡后,下列叙述不正确的是( )
A.升高温度;X的体积分数增大
B.增大压强(缩小容器体积),Z的物质的量不变
C.保持容器体积不变,充入稀有气体,Y的浓度不变
D.保持容器体积不变,充入一定量的Z,X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)
![]() bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g) △H<0。下图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息判断,下列说法中正确的是
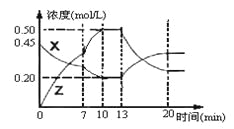
A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/(L·min)
B.化学方程式中a:b= 1:3,
C.推测在第7min时曲线变化的原因可能是增加X的浓度
D.推测该反应处于化学平衡状态的时间是10min--13min及第20min 后
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是一种重要的化工原料。工业上用硫酸钠来制得硫化钠。制备硫化钠的反应原理为: Na2SO4(s)+4H2(g) ![]() Na2S(s)+4H2O(g) △H>0,已知该可逆反应在1000°C时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
Na2S(s)+4H2O(g) △H>0,已知该可逆反应在1000°C时达到平衡,并保持反应器内恒温恒容。试回答下列问题:
(1)此可逆反应的平衡常数表达式可表示为________,若只改变一个影响因素,当平衡移动时,K值________变化(填“一定”或“不一定”);当K值变大时,逆反应速率________.(填“增大”、“减小”或“不变”)
(2)该反应达到平衡时下列说活错误的是________。
a.容器内压强保持不变
b.氢气和水蒸汽的物质的量之比保持不变
c.加入少量Fe2O3固体,平衡向逆反应方向移动
d.移除部分Na2S固体,平衡向正反应方向移动
(3)该温度下,在2L盛有2.74g Na2SO4的密闭容器中通入H2气体,10分钟后测得固体质量为2.164g。则10分钟内H2的平均反应速率________。
(4)请写出向Ba(ClO)2溶液中通入足量SO2气体后所发生化学反应的离子方程式____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A.Cl2与水反应:Cl2+H2O=HCl+HClO
B.Fe与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
C.CaCl2溶液和Na2CO3溶液反应:Ca2++CO32-=CaCO3↓
D.CaCO3 和稀硝酸反应:CaCO3+H+=Ca2++CO2 ↑ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向纯水中加入NaOH使溶液的pH为11,则由NaOH电离出的OH 离子浓度和水电离出的OH离子浓度之比为 ( )
A.1:1B.108:1C.5×109:1D.1010:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有80多种元素,是重要的物质资源宝库,同时海水具有强大的自然调节能力,为解决环境污染问题提供了广阔的空间。
(1)①已知不同pH条件下,水溶液中碳元素的存在形态如下图所示。

下列说法不正确的是_____________ (填字母序号)。
a. pH=8时,溶液中含碳元素的微粒主要是HCO3-
b. A点,溶液中H2CO3和HCO3-浓度相同
c. 当c(HCO3-)=c(CO32-)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是_____________。
(2)海水pH稳定在7.9~8.4之间,可用于烟道气中CO2和SO2的吸收剂。
①海水中含有的OH-可以吸收烟道气中的CO2,同时为海水脱钙,生产CaCO3。写出此反应的离子方程式:_____________。
②已知:25℃时,H2CO3电离平衡常数K1=4.3×10-7 K2=5.6×10-11
H2SO3电离平衡常数K1=1.5×10-2 K2=6.0×10-8
海水中含有的HCO3-可用于吸收SO2,该过程产物中有CO2和_____________。
(3)洗涤烟气后的海水呈酸性,需处理后再行排放。与新鲜海水混合同时鼓入大量空气排出部分CO2,是一种处理的有效方式。
①通入O2可将酸性海水中的硫(IV)氧化,该反应的离子方程式是_____________。
②上述方式使处理后海水pH升高的原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com