

 ,
, ,反应E-→F的化学方程式是:
,反应E-→F的化学方程式是: $→_{△}^{氢氧化钠/醇溶液}$
$→_{△}^{氢氧化钠/醇溶液}$ +HBr.
+HBr.分析 分子式为C7H8的芳香烃一定是甲苯,即A的结构简式是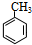 .在光照下,甲苯和单质溴发生甲基上的取代反应,结合H的分子式可知,发生一溴取代,所以B的结构简式是
.在光照下,甲苯和单质溴发生甲基上的取代反应,结合H的分子式可知,发生一溴取代,所以B的结构简式是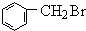 .卤代烃水解得到醇,故C是
.卤代烃水解得到醇,故C是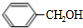 ,B到H从分子式的变化来看,H比B多了6个氢原子,因此B和氢气加成生成了H,则H结构简式为
,B到H从分子式的变化来看,H比B多了6个氢原子,因此B和氢气加成生成了H,则H结构简式为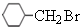 ,H到I少了1个氢原子和1个溴原子,因此发生的是消去反应,则I为
,H到I少了1个氢原子和1个溴原子,因此发生的是消去反应,则I为 .D是A的对位一取代物,则D的结构简式为:
.D是A的对位一取代物,则D的结构简式为: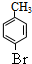 ,H与E,则D与氢气发生加成反应生成E为
,H与E,则D与氢气发生加成反应生成E为 ,I与F分别互为同分异构体,则E发生消去反应生成F为
,I与F分别互为同分异构体,则E发生消去反应生成F为 ,由G的分子式可知,E发生水解反应生成G,则G的结构简式为
,由G的分子式可知,E发生水解反应生成G,则G的结构简式为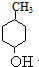 ,据此解答.
,据此解答.
解答 解:(1)分子式为C7H8的芳香烃一定是甲苯,即A的结构简式是 .在光照下,甲苯和单质溴发生甲基上的取代反应,结合H的分子式可知,发生一溴取代,所以B的结构简式是
.在光照下,甲苯和单质溴发生甲基上的取代反应,结合H的分子式可知,发生一溴取代,所以B的结构简式是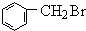 .卤代烃水解得到醇,故C是
.卤代烃水解得到醇,故C是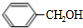 ,B到H从分子式的变化来看,H比B多了6个氢原子,因此B和氢气加成生成了H,则H结构简式为
,B到H从分子式的变化来看,H比B多了6个氢原子,因此B和氢气加成生成了H,则H结构简式为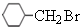 ,H到I少了1个氢原子和1个溴原子,因此发生的是消去反应,则I为
,H到I少了1个氢原子和1个溴原子,因此发生的是消去反应,则I为 ,
,
故答案为: ;
;
(2)反应B→C的化学方程式是 ,E为
,E为 ,I与F分别互为同分异构体,则E发生消去反应生成F为
,I与F分别互为同分异构体,则E发生消去反应生成F为 ,E→F的化学方程式是
,E→F的化学方程式是 $→_{△}^{氢氧化钠/醇溶液}$
$→_{△}^{氢氧化钠/醇溶液}$ +HBr,
+HBr,
故答案为: ;
; $→_{△}^{氢氧化钠/醇溶液}$
$→_{△}^{氢氧化钠/醇溶液}$ +HBr;
+HBr;
(3)证明溴代烃中含有溴原子,可以先再碱性条件下发生水解反应,再由硝酸酸化的硝酸银检验溴离子,生成淡黄色沉淀,说明含有溴元素,所需要的试剂:NaOH溶液,HNO3、AgNO3,
故答案为:NaOH溶液(氢氧化钠醇溶液)、HNO3、AgNO3;
(4)E→F是消去反应,E→G是水解反应,
A.消去反应、水解反应均有溴离子生成,故A错误;
B.因为混合液中含有氢氧化钠,因此加入溴水,溴水会和氢氧化钠反应颜色也会褪去,故B错误;
C.反应后的混合液中加入盐酸酸化后,加入溴的CCl4溶液,溶液褪色,说明消去反应生成碳碳双键,故C正确;
D.酸性高锰酸钾溶液也会氧化溴离子而褪色,故D错误,
故答案为:C.
点评 本题考查有机物推断,根据题给信息结合反应条件进行推断,判断A为甲苯,再充分根据有机物分子式进行推断,需要学生熟练掌握官能团的性质与转化,侧重考查学生分析推断能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.01×1023个CCl4所占的体积约为11.2 L | |
| B. | 80 g NH4NO3晶体中约含有NH4+ 6.02×1023个 | |
| C. | 3.9 gNa2O2吸收足量的CO2时转移的电子数约是3.01×1022 | |
| D. | 46 g NO2和N2O4混合气体中含有原子数约为1.806×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
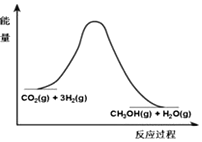 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引用了各界的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),该反应的能量变化如图所示:| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都能产生丁达尔效应 | |
| B. | 有相同的颜色 | |
| C. | 分散质颗粒直径都在1-100nm之间 | |
| D. | 加入浓氢氧化钠溶液都产生红褐色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯是无色带有特殊气味的液体 | |
| B. | 常温下苯是一种不溶于水且密度小于水的液体 | |
| C. | 苯在一定条件下能与溴发生取代反应 | |
| D. | 苯不具有典型的双键所应具有的发生加成反应的特性,故不可能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com