
分析 ①依据m=CVM计算需要溶质的质量;
②根据配制一定物质的量浓度的溶液的配制步骤选择需要的仪器;
③分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:①配制500mL 0.1mol•L-1的碳酸钠溶液,需要Na2CO3•10H2O的质量为:0.5L×0.1mol/L×286g/mol=14.3g;
故答案为;14.3;
②溶液配制操作步骤有:称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取药品,在烧杯中溶解,并用玻璃棒搅拌,冷却后转移到500ml容量瓶中,并用玻璃棒引流,洗涤并将该洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、500mL容量瓶、胶头滴管、玻璃棒、烧杯、量筒、钥匙,
需要的玻璃仪器有:500 mL容量瓶 烧杯 玻璃棒 胶头滴管;
故答案为:500 mL容量瓶 烧杯 玻璃棒 胶头滴管;
③A.定容时仰视刻度,导致溶液体积偏大,溶液浓度偏低,故A选;
B.称量时用了生锈的砝码,导致秤取的溶质的质量偏大,溶质的物质的量偏大,溶液浓度偏高,故B不选;
C.碳酸钠中含有不溶性杂质,导致溶质的物质的量偏小,溶液浓度偏低,故C选;
D.小烧杯洗净后未干燥即用来称量,称量利用的是烧杯的质量差,所以不影响配制结果,故D不选;
故选:AC.
点评 本题考查了配制一定物质的量浓度的溶液的方法及误差分析,明确配制原理及操作步骤是解题关键,注意依据C=$\frac{n}{V}$进行误差分析的方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
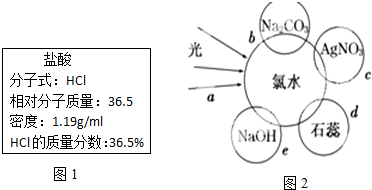
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
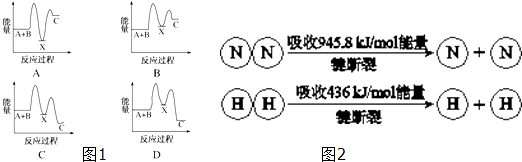
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
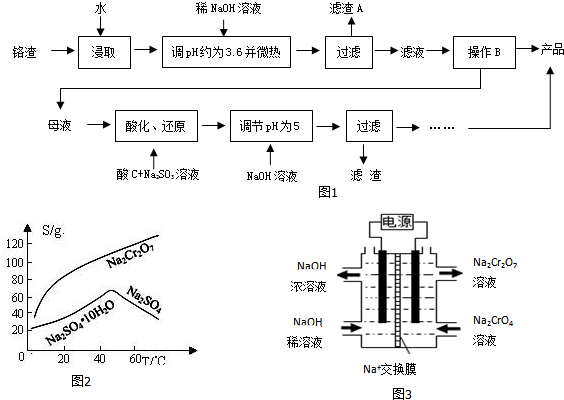
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
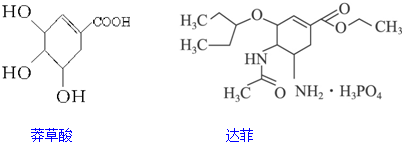
| A. | 它们互为同系物 | |
| B. | 莽草酸和达菲都能使溴的四氯化碳溶液褪色 | |
| C. | 达菲在热的NaOH溶液中能稳定存在 | |
| D. | 1 mol莽草酸可与4 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )
如图表示4个碳原子相互结合的几种方式.小圆球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合,则下列说法正确的是( )| A. | 图中属于烷烃的是A、C、H | |
| B. | 图中C和F分子中氢原子数相同 | |
| C. | 图中物质碳元素的质量分数最大的是C | |
| D. | 图中与B互为同分异构体的有E、F、H |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
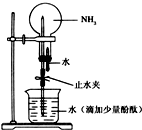 有关氨的实验室制取和性质实验如下:
有关氨的实验室制取和性质实验如下:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
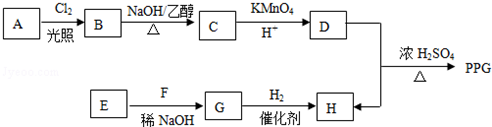
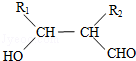
 .
. .
. .
. (写构简式)
(写构简式)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
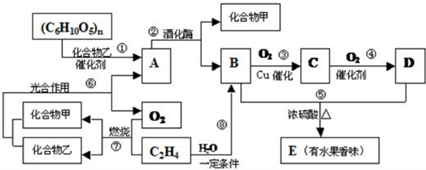
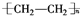 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com