
科目:高中化学 来源:2016-2017学年安徽省高二上期中化学试卷(解析版) 题型:选择题
某一溴代烷水解后的产物在红热铜丝催化下, 最多可被空气氧化生成4种不同的醛,该一溴代烷的分子式可能是
A.C4H9Br B.C5H11Br C.C6H13Br D.C7H15Br
查看答案和解析>>
科目:高中化学 来源:2017届内蒙古高三上模拟三化学试卷(解析版) 题型:实验题
从银铜合金废料中回收银并制备铜化工产品的工艺如下:
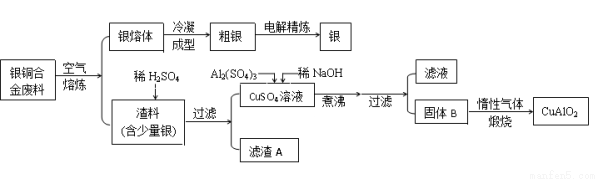
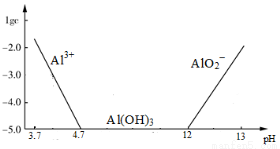
已知:①铝元素在溶液中的存在形态与溶液pH的关系如图所示。
②室温时,Cu(OH)2的溶度积Ksp=2.0×10-20,当溶液中某种离子浓度小于1.0×10-5mol/L时,认为该离子沉淀完全,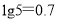 。
。
③Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃。
请回答下列问题:
(1)电解精炼银时,粗银做 极(填“阴”或“阳”),电解质选用________溶液,阴极电极反应为 。
(2)在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在 ,若控制不当,使NaOH过量可能会引起的反应的离子方程式为 。
(3) 煅烧过程中发生多步反应,写出最终生成CuAlO2的反应的化学方程式: 。
(4)若银铜合金中铜的质量分数为64%,理论上1.0 kg废料中的铜可完全转化为CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液 L。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
25℃和101kPa时,乙炔和丙烯组成的混合烃32mL,与过量氧气混合并完全燃烧,除去水蒸气,恢复到原来的温度和压强,气体总体积缩小了72mL,原混合烃中乙炔体积分数为
A. 12.5% B. 25% C. 50% D. 75%
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
已知室温时,0.1mol/L的一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.溶液的PH=4
B.升高温度,溶液PH增大
C.此酸的电离平衡常数为1×10-7
D.由HA电离的c(H+)约为水电离出来的c(H+)的106倍
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高二上期中化学试卷(解析版) 题型:选择题
分子式为C2H6O的可能是甲醚或乙醇,可采用化学方法及物理方法加以鉴别,下列鉴别方法中不能对二者进行鉴别的是
A.利用金属钠或者金属钾 B.利用质谱
C.利用红外光谱法 D.利用核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高二12月月考化学卷(解析版) 题型:实验题
某小组同学要配制100mL0.100 mol/ LNa2CO3溶液。下图是一些关键步骤和操作。
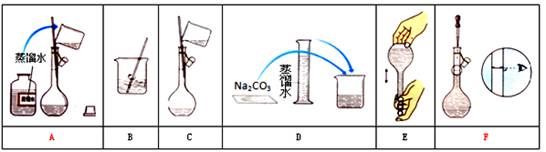
(1) 配制过程的先后顺序为(用字母A-F填写)_____________。
(2) 配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、__________。
(3) 若用Na2CO3·10H2O晶体来配制溶液,但晶体己经部分失去结晶水,则所配得溶液的浓度会____________ (填“偏高”、“偏低”、“不变”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆实验中学高一12月月考化学卷(解析版) 题型:填空题
Na是一种非常重要的金属单质。
(1)下列关于金属钠的叙述错误的是( )
A.钠的还原性很强,只能以化合态存在于自然界
B.钠质地柔软,可用小刀切割,保存 在煤油中
在煤油中
C.从试剂瓶中取出并切下的未使用的钠可放回原试剂瓶中
D.钠失火后可用大量水或泡沫灭火器扑灭
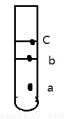
(2)在试管内注入煤油和FeSO4溶液,静置后将一块钠投入试管中,则钠落在 (a、b、c)处,请一步写出发生的相应总离子反应方程式为 。
(3)将少量的Na投入到饱和NH4Cl溶液中,反应产生的两种气体为 和 (填化学式)。请一步写出相应的化学反应方程式 。
(4)将少量的Na投入到足量的Ca(HCO3)2溶液中,请一步写出相应的总离子反应方程式 。
(5)已知有150mL 1mol/L NaOH 溶液,向该溶液通入标况下2.24LCO2请一步写出相应的总离子反应方程式 。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上调研四化学试卷(解析版) 题型:填空题
以含有Al2O3、Fe2O3等杂质的铬铁矿[主要成分为Fe(CrO2)2]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O)的主要工艺流程如下:
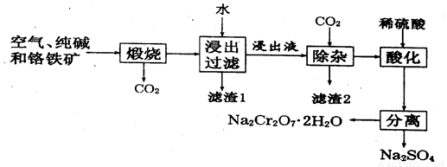
己知:铬铁矿在空气中与纯减煅烧生成Na2CrO4和一种红棕色固体,同时释放出CO2气体,
且 Al2O3+Na2CO3 2NaAlO2+ CO2↑。请回答:
2NaAlO2+ CO2↑。请回答:
(1)在铬铁矿Fe(CrO2)2中,Cr的化合价为___________。
(2)滤渣2的成分为_____________。
(3)将滤渣1放入稀硫酸溶解后得溶液W,检验该溶液中金属离子的方法是_________。
(4)根据有关国家标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7mol/L以下才能排放。含CrO42-的废水处理通常有以下两种方法。
①沉淀法:
加入可溶性钡盐生成BaCrO4沉淀[Ksp(BaCrO4)=1.2×10-10],再加入可溶性硫酸盐处理多余的Ba2+。加入可溶性钡盐后的废水中Ba2+的浓度应不小于________________mol/L,后续废水处理方能达到国家排放标准。
②还原法:CrO42-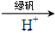 Cr3+
Cr3+ Cr(OH)3。写出酸性条件下CrO42-与绿巩在溶液中反应的离子方程式:_________________________________。
Cr(OH)3。写出酸性条件下CrO42-与绿巩在溶液中反应的离子方程式:_________________________________。
(5)某高效净水剂是由K2FeO4得到的,工业上以溶液w、次氯酸钾和氢氧化钾为原料制备K2FeO4,该反应的离子方程式是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com